Sprawdzian Z Soli Klasa 8 Chemia

Czy zbliża się sprawdzian z soli w 8 klasie chemii i czujesz narastający stres? Zrozumiale! Sole to ważny, ale często sprawiający trudności temat. Dobra wiadomość jest taka, że opanowanie podstaw chemii soli może być prostsze, niż myślisz. Ten artykuł pomoże Ci zrozumieć kluczowe zagadnienia i przygotować się do sprawdzianu, abyś mógł go zdać z sukcesem.
Czym są sole? – Podstawy, które musisz znać
Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Ta reakcja nazywa się reakcją zobojętniania. Pamiętaj, że sól składa się z kationu metalu (pochodzącego od zasady) i anionu reszty kwasowej (pochodzącego od kwasu). Brzmi skomplikowanie? Spójrzmy na prosty przykład.
Przykład: Weźmy kwas solny (HCl) i wodorotlenek sodu (NaOH). Reagują one ze sobą, tworząc chlorek sodu (NaCl), czyli sól kuchenną, i wodę (H₂O). Równanie reakcji wygląda następująco:
HCl + NaOH → NaCl + H₂O
Tutaj, Na+ (kation sodu) pochodzi od zasady (NaOH), a Cl- (anion chlorkowy) pochodzi od kwasu (HCl). To jest sól! Proste, prawda?
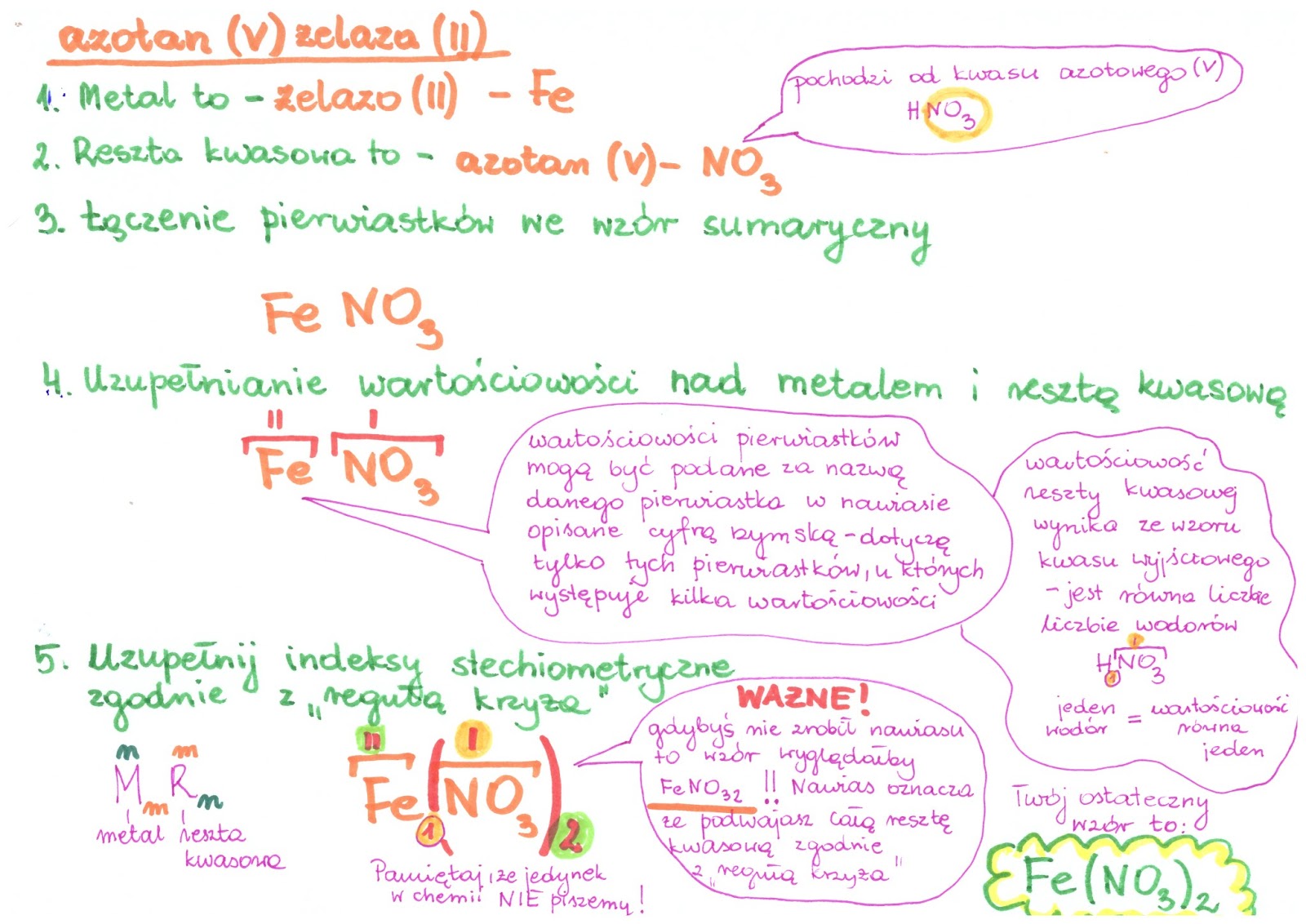
Nazewnictwo soli – Jak to rozgryźć?
Kolejnym wyzwaniem jest nazewnictwo soli. Kluczem jest znajomość nazw kwasów i odpowiadających im reszt kwasowych. Generalnie, nazwa soli składa się z dwóch części: nazwy reszty kwasowej i nazwy metalu. Kilka przykładów:
- Kwas siarkowy(VI) (H₂SO₄) tworzy sole zwane siarczanami(VI), np. siarczan(VI) miedzi(II) (CuSO₄).
- Kwas azotowy(V) (HNO₃) tworzy sole zwane azotanami(V), np. azotan(V) potasu (KNO₃).
- Kwas węglowy (H₂CO₃) tworzy sole zwane węglanami, np. węglan wapnia (CaCO₃).
Zauważ, że w nawiasie umieszczamy wartościowość metalu, jeśli ma on więcej niż jedną. Na przykład, żelazo może występować na stopniach utlenienia II i III, więc mamy chlorek żelaza(II) (FeCl₂) i chlorek żelaza(III) (FeCl₃).
Wskazówka: Stwórz tabelę z najczęściej spotykanymi kwasami, ich resztami kwasowymi i nazwami odpowiadających soli. Regularne powtarzanie tych nazw pomoże Ci je zapamiętać.
Otrzymywanie soli – Różne metody, ten sam cel
Sole można otrzymywać na wiele sposobów. Najważniejsze to:
- Reakcja kwasu z zasadą (zobojętnianie): Tak jak w przykładzie z NaCl.
- Reakcja metalu z kwasem: Na przykład, reakcja magnezu (Mg) z kwasem solnym (HCl) daje chlorek magnezu (MgCl₂) i wodór (H₂).
- Reakcja tlenku metalu z kwasem: Na przykład, reakcja tlenku miedzi(II) (CuO) z kwasem siarkowym(VI) (H₂SO₄) daje siarczan(VI) miedzi(II) (CuSO₄) i wodę (H₂O).
- Reakcja metalu z niemetalem: Na przykład, reakcja sodu (Na) z chlorem (Cl₂) daje chlorek sodu (NaCl).
- Reakcja soli z solą: Jeśli reakcja prowadzi do powstania osadu. Na przykład, reakcja azotanu(V) srebra(I) (AgNO₃) z chlorkiem sodu (NaCl) daje chlorek srebra(I) (AgCl) (osad) i azotan(V) sodu (NaNO₃).
Wskazówka: Zwróć uwagę na strzałki w dół (↓) w równaniach reakcji. Oznaczają one, że powstaje osad, czyli substancja nierozpuszczalna w wodzie. Powstawanie osadu jest często warunkiem zajścia reakcji wymiany pomiędzy solami.
Właściwości soli – Co warto zapamiętać?
Właściwości soli są bardzo zróżnicowane i zależą od rodzaju kationu i anionu, z których są zbudowane. Kilka ogólnych cech to:
- Stan skupienia: Zazwyczaj są to ciała stałe w temperaturze pokojowej.
- Rozpuszczalność: Nie wszystkie sole są dobrze rozpuszczalne w wodzie. Rozpuszczalność zależy od rodzaju soli i temperatury. Sprawdź tablicę rozpuszczalności! Jest bardzo przydatna na sprawdzianie.
- Barwa: Niektóre sole są bezbarwne (np. NaCl), a inne mają charakterystyczne kolory (np. CuSO₄ – niebieski).
- Smak: Niektóre sole są słone (np. NaCl), a inne mają smak gorzki lub metaliczny. Nigdy nie próbuj soli w laboratorium!
- Przewodnictwo elektryczne: Sole w stanie stopionym lub rozpuszczone w wodzie przewodzą prąd elektryczny.
Znaczenie soli – Gdzie je spotykamy?
Sole odgrywają ogromną rolę w naszym życiu. Znajdujemy je w:
- Żywności: Sól kuchenna (NaCl) jest niezbędna do życia i używana jako przyprawa.
- Nawozach: Sole azotanowe i fosforanowe są stosowane jako nawozy w rolnictwie.
- Lekach: Wiele leków zawiera sole, np. wodorowęglan sodu (NaHCO₃) jako lek na zgagę.
- Budownictwie: Węglan wapnia (CaCO₃) jest głównym składnikiem wapna i cementu.
- Przemyśle: Sole są wykorzystywane w wielu procesach przemysłowych, np. w produkcji szkła, papieru i tworzyw sztucznych.
Jak się uczyć do sprawdzianu z soli? – Praktyczne porady
Oto kilka wskazówek, które pomogą Ci przygotować się do sprawdzianu:
- Przejrzyj notatki z lekcji: Upewnij się, że rozumiesz podstawowe definicje i pojęcia.
- Rozwiąż zadania z podręcznika: Ćwiczenia pomogą Ci utrwalić wiedzę i zrozumieć, jak stosować ją w praktyce.
- Skorzystaj z tablicy rozpuszczalności: Naucz się z niej korzystać! To bardzo przydatne narzędzie.
- Powtórz nazewnictwo soli: Stwórz własną tabelę z nazwami kwasów i odpowiadających im soli.
- Zrób kartkówki: Sprawdź swoją wiedzę za pomocą krótkich testów. Możesz poprosić kogoś o pomoc w przygotowaniu kartkówki.
- Wyjaśnij komuś innemu: Tłumaczenie materiału komuś innemu pomoże Ci lepiej go zrozumieć.
- Znajdź dodatkowe materiały: Skorzystaj z internetu, aby znaleźć dodatkowe ćwiczenia i wyjaśnienia.
Wskazówka: Ucz się regularnie, a nie tylko na dzień przed sprawdzianem. Regularne powtarzanie materiału pomoże Ci go lepiej zapamiętać.
Typowe zadania na sprawdzianie – Przykłady i rozwiązania
Sprawdziany z soli często zawierają zadania polegające na:
- Nazewnictwie soli: Nazywanie soli na podstawie ich wzorów i odwrotnie.
- Zapisywaniu równań reakcji otrzymywania soli: Uzupełnianie równań reakcji lub przewidywanie produktów reakcji.
- Określaniu rozpuszczalności soli: Sprawdzanie rozpuszczalności soli w wodzie za pomocą tablicy rozpuszczalności.
- Rozwiązywaniu zadań obliczeniowych: Obliczanie masy molowej soli lub ilości substancji w reakcji.
- Rozpoznawaniu soli: Na podstawie obserwacji (np. koloru roztworu) lub wyników reakcji.
Przykład zadania:
Zadanie: Napisz równanie reakcji kwasu siarkowego(VI) z wodorotlenkiem potasu.
Rozwiązanie:
H₂SO₄ + 2KOH → K₂SO₄ + 2H₂O
Nazwa soli: siarczan(VI) potasu
Podsumowanie – Klucz do sukcesu
Opanowanie chemii soli wymaga zrozumienia podstawowych definicji, znajomości nazewnictwa, metod otrzymywania i właściwości. Regularna nauka, rozwiązywanie zadań i korzystanie z tablicy rozpuszczalności to klucz do sukcesu na sprawdzianie. Pamiętaj, że chemia może być fascynująca! Nie zrażaj się trudnościami i ciesz się odkrywaniem nowych związków chemicznych.
Powodzenia na sprawdzianie!