Sprawdzian Z Kwasów Klasa 8
Czy czeka Cię wkrótce sprawdzian z kwasów w 8 klasie? Jeśli tak, prawdopodobnie czujesz mieszankę emocji – od ciekawości po lekkie zaniepokojenie. Nie martw się, nie jesteś sam! Kwasy to temat, który na początku wydaje się skomplikowany, ale z odpowiednim podejściem staje się całkiem zrozumiały. W tym artykule postaramy się rozłożyć go na czynniki pierwsze, tak aby sprawdzian nie był już powodem do stresu, a okazją do pokazania swojej wiedzy.
Czym Właściwie Są Kwasy?
Zacznijmy od podstaw. Czym w ogóle są kwasy? Wyobraź sobie, że masz lemoniadę. Jej kwaśny smak pochodzi właśnie od kwasu cytrynowego. Kwasy to związki chemiczne, które w roztworach wodnych uwalniają jony wodorowe (H+). To właśnie te jony odpowiadają za charakterystyczne właściwości kwasów.
Charakterystyczne cechy kwasów:
- Kwaśny smak: Pamiętaj jednak, że nie wolno próbować kwasów laboratoryjnych! Są żrące i niebezpieczne.
- Reakcja z metalami: Niektóre kwasy reagują z metalami, wydzielając wodór.
- Odbarwianie wskaźników: Kwasy zmieniają barwę wskaźników chemicznych (np. papierek uniwersalny staje się czerwony).
- Reakcja z zasadami (neutralizacja): Kwasy reagują z zasadami, tworząc sól i wodę.
Możesz pomyśleć: "Ale po co mi ta wiedza w życiu?". Otóż kwasy są wszędzie! W żołądku mamy kwas solny (HCl), który pomaga trawić pokarm. Ocet, którego używamy w kuchni, to roztwór kwasu octowego (CH3COOH). Nawet deszcze, ze względu na obecność dwutlenku węgla w atmosferze, mają lekko kwaśny odczyn.
Podział Kwasów
W 8 klasie najczęściej spotkasz się z podziałem kwasów na tlenowe i beztlenowe. Kluczem do ich rozróżnienia jest – zgadza się – obecność tlenu w cząsteczce kwasu.
Kwasy Beztlenowe
Kwasy beztlenowe, jak sama nazwa wskazuje, nie zawierają atomów tlenu. Składają się z wodoru i niemetalu. Najpopularniejsze przykłady to:
- Kwas chlorowodorowy (HCl): Znany również jako kwas solny. Silny kwas stosowany w przemyśle i w żołądku do trawienia.
- Kwas bromowodorowy (HBr): Stosowany w syntezie organicznej.
- Kwas jodowodorowy (HI): Silny kwas redukujący.
- Kwas siarkowodorowy (H2S): Charakteryzuje się zapachem zgniłych jaj. Jest trujący.
Nazewnictwo kwasów beztlenowych jest proste: "kwas" + nazwa niemetalu + "owodorowy".
Kwasy Tlenowe
Kwasy tlenowe zawierają w swojej cząsteczce atomy wodoru, tlenu i niemetalu (tzw. reszta kwasowa). Są one bardziej zróżnicowane niż kwasy beztlenowe.
- Kwas siarkowy(VI) (H2SO4): Bardzo silny kwas, stosowany w wielu gałęziach przemysłu.
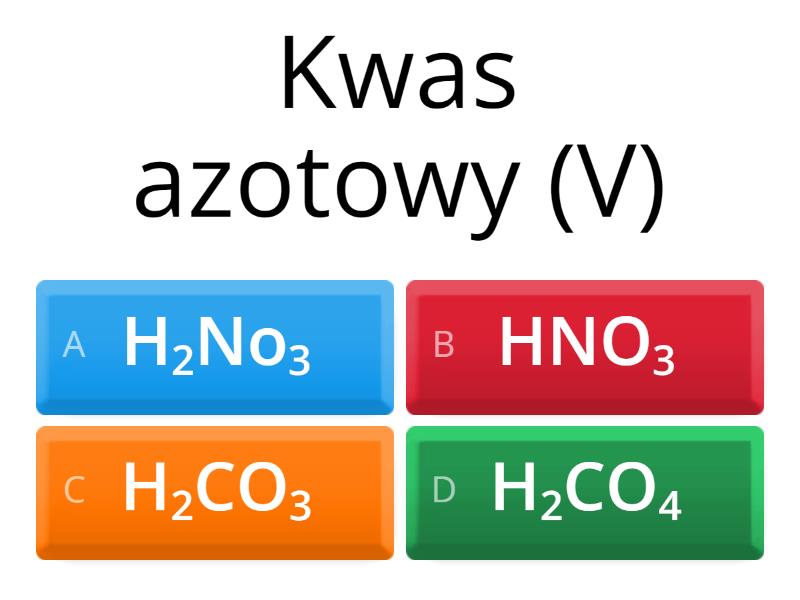
- Kwas azotowy(V) (HNO3): Stosowany do produkcji nawozów i materiałów wybuchowych.
- Kwas węglowy (H2CO3): Powstaje w wyniku rozpuszczania dwutlenku węgla w wodzie. Jest obecny w napojach gazowanych.
- Kwas fosforowy(V) (H3PO4): Stosowany w przemyśle spożywczym i jako składnik nawozów.
Nazewnictwo kwasów tlenowych jest nieco bardziej skomplikowane i zależy od stopnia utlenienia niemetalu w reszcie kwasowej. Tutaj warto zapamiętać kilka podstawowych zasad i nazw.
Reakcje Charakterystyczne dla Kwasów
Zrozumienie reakcji chemicznych, w których biorą udział kwasy, jest kluczowe do sukcesu na sprawdzianie. Oto kilka najważniejszych:
- Reakcja z metalami:
Kwas + metal → sól + wodór
Przykład: 2HCl + Zn → ZnCl2 + H2
Pamiętaj: nie wszystkie metale reagują z kwasami! Reaktywność metali określa szereg elektrochemiczny.
- Reakcja z tlenkami metali:
Kwas + tlenek metalu → sól + woda
Przykład: H2SO4 + CuO → CuSO4 + H2O
- Reakcja z wodorotlenkami (neutralizacja):
Kwas + wodorotlenek → sól + woda
Przykład: HCl + NaOH → NaCl + H2O
- Reakcja z solami:
Kwas + sól → inny kwas + inna sól
Warunek: musi powstać słabszy kwas lub związek nierozpuszczalny (osad).
Przykład: H2SO4 + BaCl2 → 2HCl + BaSO4 (osad)
Spróbuj samodzielnie napisać kilka równań reakcji, korzystając z powyższych schematów. To świetny sposób na utrwalenie wiedzy!
Wskaźniki Kwasowo-Zasadowe
Wskaźniki kwasowo-zasadowe to substancje, które zmieniają barwę w zależności od pH roztworu (czyli od jego kwasowości lub zasadowości). Najczęściej spotykane wskaźniki to:
- Papierek uniwersalny: Przyjmuje różne barwy w zależności od pH (od czerwonej dla kwasów do niebieskiej/fioletowej dla zasad).
- Lakmus: W kwasach barwi się na czerwono, w zasadach na niebiesko.
- Fenoloftaleina: W kwasach i roztworach obojętnych jest bezbarwna, w zasadach barwi się na malinowo.
- Oranż metylowy: W kwasach barwi się na czerwono, w zasadach na żółto.
Pamiętaj o barwach, jakie przyjmują wskaźniki w roztworach kwasowych! To często pojawia się na sprawdzianach.
Bezpieczeństwo Pracy z Kwasami
Praca z kwasami wymaga zachowania szczególnej ostrożności. Kwasy mogą być żrące i powodować poważne oparzenia. Należy zawsze przestrzegać następujących zasad:
- Nosić okulary ochronne i rękawice.
- Pracować w dobrze wentylowanym pomieszczeniu.
- Nigdy nie dodawać wody do kwasu! Zawsze wlewaj kwas do wody, powoli i mieszając.
- W przypadku kontaktu kwasu ze skórą, natychmiast spłukać dużą ilością wody.
- Wiedzieć, gdzie znajdują się środki neutralizujące (np. roztwór sody oczyszczonej).
To nie są żarty! Pamiętaj, bezpieczeństwo jest najważniejsze.
Przykładowe Zadania z Kwasów (i jak je rozwiązywać)
Żeby sprawdzian nie był zaskoczeniem, warto przećwiczyć rozwiązywanie zadań. Oto kilka przykładów:
- Zadanie: Napisz równanie reakcji kwasu siarkowego(VI) z tlenkiem magnezu.
- Zadanie: Jakiego koloru będzie papierek uniwersalny w roztworze kwasu solnego?
- Zadanie: Napisz wzór sumaryczny kwasu bromowodorowego.
Rozwiązanie: H2SO4 + MgO → MgSO4 + H2O
Krok po kroku: Zidentyfikuj reagenty (kwas i tlenek metalu). Określ produkty (sól i woda). Zbilansuj równanie.
Rozwiązanie: Czerwony.
Krok po kroku: Przypomnij sobie barwy, jakie przyjmuje papierek uniwersalny w różnych roztworach (czerwony – kwas, zielony – obojętny, niebieski/fioletowy – zasada).
Rozwiązanie: HBr
Krok po kroku: Zidentyfikuj niemetal (brom – Br). Połącz go z wodorem (H). Kwas bromowodorowy jest kwasem beztlenowym, więc jego wzór to HBr.
Im więcej zadań rozwiążesz, tym pewniej poczujesz się na sprawdzianie.
Adresowanie Potencjalnych Wątpliwości
Możesz pomyśleć: "Po co nam tyle tych kwasów? Czy nie są szkodliwe dla środowiska?". To ważne pytanie! Niestety, nadmierna emisja niektórych kwasów (np. kwasu siarkowego i azotowego) do atmosfery przyczynia się do powstawania kwaśnych deszczy, które niszczą lasy, zakwaszają glebę i wody. Dlatego tak ważne jest ograniczanie emisji zanieczyszczeń i stosowanie technologii, które zapobiegają powstawaniu tych szkodliwych substancji. Z drugiej strony, kwasy są niezbędne w wielu procesach przemysłowych i w życiu codziennym (np. w produkcji nawozów, leków, tworzyw sztucznych).
Podsumowanie i Dalsze Kroki
Przygotowanie do sprawdzianu z kwasów w 8 klasie wymaga zrozumienia podstawowych pojęć, znajomości nazw i wzorów kwasów, umiejętności pisania równań reakcji i świadomości zasad bezpieczeństwa. Pamiętaj, że nauka to proces! Nie zrażaj się trudnościami i ćwicz regularnie. Zastosuj techniki aktywnego uczenia się, takie jak robienie notatek, rozwiązywanie zadań i tłumaczenie zagadnień innym osobom.
Czy masz jakieś pytania dotyczące kwasów, na które chciałbyś uzyskać odpowiedź? Spróbuj powtórzyć materiał i rozwiązać dodatkowe zadania. Powodzenia na sprawdzianie! A po nim, może zrobisz sobie zasłużoną szklankę lemoniady? Tylko pamiętaj, z umiarem!