Sprawdzian Z Kwasów 2 Gimnazjum

Sprawdzian z kwasów w drugiej klasie gimnazjum to dla wielu uczniów istotny moment w nauce chemii. Ocena z tego sprawdzianu często wpływa na ocenę semestralną i roczną, dlatego warto się do niego solidnie przygotować. Kwasami zajmujemy się na lekcjach chemii, ale także spotykamy je w życiu codziennym. Zrozumienie ich właściwości i reakcji chemicznych jest kluczowe dla sukcesu na sprawdzianie i w dalszej nauce chemii.
Czym są kwasy? Definicja i charakterystyka
Kwasy to związki chemiczne, które w roztworach wodnych dysocjują na kationy wodoru (H+) i aniony reszty kwasowej. Charakterystyczną cechą kwasów jest ich kwaśny smak (chociaż nigdy nie należy ich smakować w laboratorium!), zdolność do reagowania z metalami (nie ze wszystkimi!), zasadami i tlenkami metali, tworząc sole i wodę.
Podział kwasów
Kwasy dzielimy na różne grupy w zależności od ich składu, mocy i innych właściwości. Najczęściej spotykany podział to:
- Kwasy beztlenowe: Zawierają tylko wodór i resztę kwasową (np. kwas chlorowodorowy HCl, kwas siarkowodorowy H2S).
- Kwasy tlenowe: Zawierają wodór, tlen i resztę kwasową (np. kwas siarkowy(VI) H2SO4, kwas azotowy(V) HNO3).
Innym kryterium podziału jest moc kwasu, czyli jego zdolność do dysocjacji w roztworze wodnym. Dzielimy je na:
- Kwasy mocne: Dysocjują w dużym stopniu (prawie całkowicie) w roztworze wodnym (np. HCl, H2SO4, HNO3).
- Kwasy słabe: Dysocjują w niewielkim stopniu (częściowo) w roztworze wodnym (np. CH3COOH - kwas octowy, H2CO3 - kwas węglowy).
Moc kwasu ma ogromny wpływ na jego właściwości i reakcje chemiczne, w których uczestniczy. Mocne kwasy reagują zazwyczaj gwałtowniej niż słabe.
Nomenklatura kwasów
Nazewnictwo kwasów jest ściśle określone i należy je znać, aby poprawnie pisać wzory i nazwy związków chemicznych. W przypadku kwasów beztlenowych nazwa tworzona jest przez dodanie do nazwy niemetalu końcówki "-wodorowy" (np. HCl - kwas chlorowodorowy, H2S - kwas siarkowodorowy).
Nazewnictwo kwasów tlenowych jest bardziej złożone i zależy od stopnia utlenienia pierwiastka centralnego. Stosuje się następujące końcówki:
- -owy(VI): Dla kwasów, w których pierwiastek centralny ma wysoki stopień utlenienia (np. H2SO4 - kwas siarkowy(VI), HNO3 - kwas azotowy(V)).
- -owy(IV): Dla kwasów, w których pierwiastek centralny ma niższy stopień utlenienia (np. H2SO3 - kwas siarkowy(IV), HNO2 - kwas azotowy(III)).
Do nazwy kwasu dodaje się wartościowość pierwiastka centralnego w nawiasie, zapisywaną cyframi rzymskimi. Praktyka w pisaniu wzorów i nazw kwasów jest kluczowa, więc warto rozwiązać jak najwięcej zadań.
Właściwości kwasów
Kwasy wykazują szereg charakterystycznych właściwości, które wynikają z obecności jonów wodorowych H+ w roztworze. Najważniejsze z nich to:
- Kwaśny smak: Należy pamiętać, że nigdy nie wolno smakować kwasów w laboratorium ze względu na ich żrące właściwości!
- Działanie na wskaźniki: Kwasy zmieniają barwę wskaźników (np. lakmus zmienia barwę na czerwono, oranż metylowy na czerwono, fenoloftaleina pozostaje bezbarwna).
- Reakcje z metalami: Kwasy reagują z niektórymi metalami, tworząc sole i wodór (np. Zn + 2HCl → ZnCl2 + H2). Nie wszystkie metale reagują z kwasami! Reaktywność metali zależy od ich położenia w szeregu napięciowym metali.
- Reakcje z tlenkami metali: Kwasy reagują z tlenkami metali, tworząc sole i wodę (np. CuO + H2SO4 → CuSO4 + H2O).
- Reakcje z zasadami (neutralizacja): Kwasy reagują z zasadami, tworząc sole i wodę (np. NaOH + HCl → NaCl + H2O). Reakcja neutralizacji jest egzotermiczna, co oznacza, że wydziela się ciepło.
- Reakcje z węglanami: Kwasy reagują z węglanami, tworząc sole, wodę i dwutlenek węgla (np. CaCO3 + 2HCl → CaCl2 + H2O + CO2). Wydzielanie dwutlenku węgla jest widoczne jako musowanie roztworu.
Zrozumienie tych reakcji jest niezbędne do rozwiązywania zadań na sprawdzianie.
Reakcje kwasów - przykłady i równania reakcji
Umiejętność pisania równań reakcji chemicznych, w których uczestniczą kwasy, jest kluczowa do zdobycia dobrej oceny na sprawdzianie. Przećwicz pisanie równań reakcji z różnymi substancjami, takimi jak metale, tlenki metali, zasady i węglany. Pamiętaj o uzgadnianiu współczynników stechiometrycznych, aby równanie było poprawne.
Oto kilka przykładów równań reakcji:
- Reakcja kwasu chlorowodorowego z magnezem: Mg + 2HCl → MgCl2 + H2
- Reakcja kwasu siarkowego(VI) z tlenkiem miedzi(II): CuO + H2SO4 → CuSO4 + H2O
- Reakcja kwasu azotowego(V) z wodorotlenkiem potasu: KOH + HNO3 → KNO3 + H2O
- Reakcja kwasu węglowego z węglanem wapnia: CaCO3 + H2CO3 → Ca(HCO3)2 (powstaje wodorowęglan wapnia, który jest rozpuszczalny w wodzie)
Zwróć uwagę na stany skupienia reagentów i produktów reakcji (s - ciało stałe, l - ciecz, g - gaz, aq - roztwór wodny).
Kwasy w życiu codziennym i przemyśle
Kwasy są wszechobecne w naszym życiu codziennym i odgrywają ważną rolę w przemyśle. Oto kilka przykładów:
- Kwas chlorowodorowy (HCl): Występuje w soku żołądkowym, gdzie wspomaga trawienie. W przemyśle stosowany do produkcji tworzyw sztucznych, oczyszczania metali i regulacji pH.
- Kwas siarkowy(VI) (H2SO4): Jest jednym z najważniejszych chemikaliów przemysłowych. Stosowany do produkcji nawozów, detergentów, barwników i tworzyw sztucznych.
- Kwas azotowy(V) (HNO3): Używany do produkcji nawozów sztucznych, materiałów wybuchowych i tworzyw sztucznych.
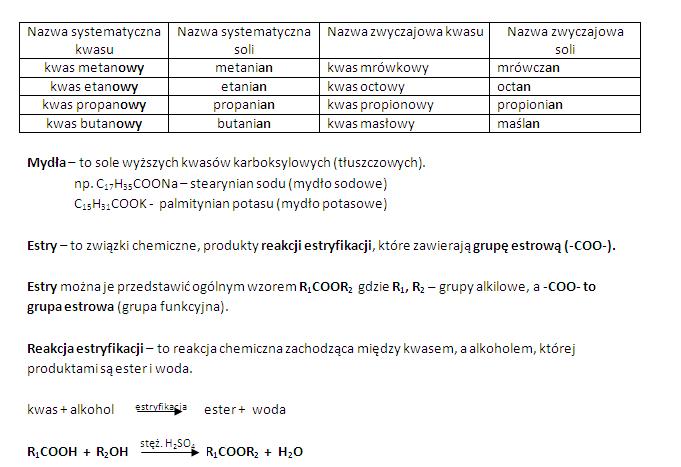
- Kwas octowy (CH3COOH): Składnik octu spożywczego, stosowany jako środek konserwujący i przyprawa.
- Kwas cytrynowy (C6H8O7): Występuje w owocach cytrusowych, stosowany jako dodatek do żywności i środek czyszczący.
Zrozumienie zastosowań kwasów w życiu codziennym pomaga docenić znaczenie chemii.
Jak przygotować się do sprawdzianu z kwasów?
Oto kilka wskazówek, które pomogą Ci przygotować się do sprawdzianu z kwasów:
- Powtórz definicje i podział kwasów. Upewnij się, że rozumiesz, co to są kwasy i jak je klasyfikujemy.
- Naucz się nazewnictwa kwasów. Ćwicz pisanie wzorów i nazw kwasów.
- Zapamiętaj właściwości kwasów. Zrozum, jak kwasy reagują z różnymi substancjami.
- Ćwicz pisanie równań reakcji chemicznych. Rozwiąż jak najwięcej zadań, aby utrwalić wiedzę.
- Rozwiąż przykładowe sprawdziany. Sprawdź swoją wiedzę i zidentyfikuj obszary, które wymagają dodatkowej nauki.
- Zadawaj pytania nauczycielowi. Jeśli masz jakieś wątpliwości, nie wahaj się zapytać.
- Ucz się systematycznie. Nie odkładaj nauki na ostatnią chwilę.
Podsumowanie
Sprawdzian z kwasów w drugiej klasie gimnazjum to ważny sprawdzian Twojej wiedzy z chemii. Solidne przygotowanie, oparte na zrozumieniu definicji, właściwości i reakcji kwasów, jest kluczem do sukcesu. Pamiętaj o regularnej nauce, rozwiązywaniu zadań i zadawaniu pytań. Powodzenia!