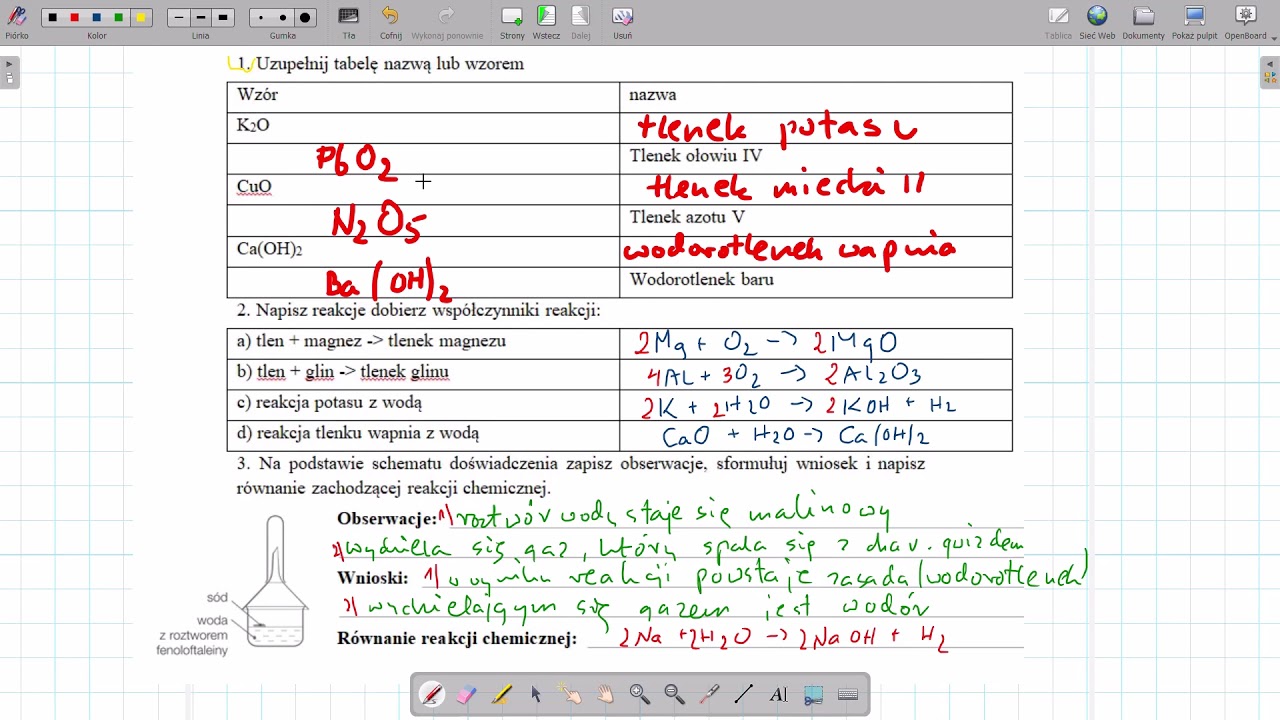
Sprawdzian Z Chemi Kl 2 Nowa Era Wodorotlenki

Wodorotlenki to związki chemiczne zbudowane z kationu metalu (lub kationu amonu, NH4+) i anionu wodorotlenkowego (OH-). Charakteryzują się one obecnością grupy wodorotlenowej, która nadaje im specyficzne właściwości.
Wzór ogólny wodorotlenku to M(OH)n, gdzie M oznacza metal, a n to wartościowość metalu, równa liczbie grup wodorotlenkowych przyłączonych do metalu. Wartościowość grupy wodorotlenowej (OH-) wynosi zawsze jeden.
Nazewnictwo wodorotlenków opiera się na nazwie metalu i dodaniu słowa "wodorotlenek". Jeżeli metal występuje na różnych stopniach utlenienia, po nazwie metalu w nawiasie podaje się jego wartościowość w danym wodorotlenku, np. wodorotlenek żelaza(II), wodorotlenek żelaza(III).
Właściwości wodorotlenków zależą od metalu, z którym są związane. Niektóre wodorotlenki są rozpuszczalne w wodzie – nazywamy je zasadami. Zasady, po rozpuszczeniu w wodzie, dysocjują na jony metali i jony wodorotlenkowe, nadając roztworowi odczyn zasadowy (pH > 7).
Przykłady:
- Wodorotlenek sodu (NaOH) – silna zasada, używana m.in. do produkcji mydła.
- Wodorotlenek wapnia (Ca(OH)2) – znany jako wapno gaszone, stosowany w budownictwie i rolnictwie.
Reakcje charakterystyczne: Wodorotlenki reagują z kwasami, tworząc sole i wodę (reakcja zobojętniania). Reakcja ta wykorzystywana jest w wielu procesach przemysłowych i laboratoryjnych.
Zastosowanie: Wodorotlenki znajdują szerokie zastosowanie w przemyśle chemicznym, farmaceutycznym, budownictwie, rolnictwie i w oczyszczaniu ścieków. Są wykorzystywane jako odczynniki chemiczne, neutralizatory, składniki nawozów i środków czyszczących.
![Sprawdzian Z Chemi Kl 2 Nowa Era Wodorotlenki SPRAWDZIAN Chemia. Klasa 7: Tlenki i wodorotlenki [5] - YouTube](https://i.ytimg.com/vi/lB-CSds7Eik/maxresdefault.jpg?sqp=-oaymwEmCIAKENAF8quKqQMa8AEB-AH-CYAC0AWKAgwIABABGGUgZShlMA8=&rs=AOn4CLBHWE0z9H8yRycaPTPRqUIQ2BXF2A)



