Sprawdzian Wodorotlenki Klasa 8 Odpowiedzi

Czy zbliża się sprawdzian z wodorotlenków w klasie 8? Czujesz lekki niepokój, nie wiesz, od czego zacząć naukę i jak usystematyzować wiedzę? Ten artykuł powstał właśnie dla Ciebie! Pomożemy Ci zrozumieć kluczowe zagadnienia dotyczące wodorotlenków, przygotować się do sprawdzianu i, co najważniejsze, polubić chemię!
Co to są wodorotlenki? Podstawy, które musisz znać.
Zacznijmy od podstaw. Wodorotlenki to związki chemiczne, które składają się z metalu (lub grupy amonowej NH4+) oraz jednej lub więcej grup hydroksylowych (OH-). To właśnie obecność tej grupy (OH-) nadaje wodorotlenkom charakterystyczne właściwości.
Wzór ogólny wodorotlenków:
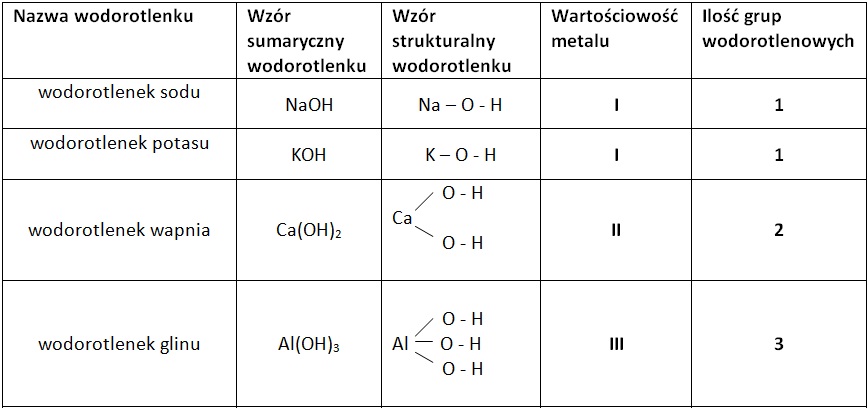
Wzór ogólny wodorotlenków to M(OH)n, gdzie:
- M – symbol metalu
- OH – grupa hydroksylowa
- n – wartościowość metalu
Wartościowość metalu decyduje o liczbie grup hydroksylowych w cząsteczce wodorotlenku. Na przykład, sód (Na) jest jednowartościowy, więc wodorotlenek sodu ma wzór NaOH. Magnez (Mg) jest dwuwartościowy, więc wodorotlenek magnezu ma wzór Mg(OH)2.
Nazewnictwo wodorotlenków:
Nazwy wodorotlenków tworzymy, dodając słowo "wodorotlenek" do nazwy metalu. Jeśli metal ma więcej niż jedną wartościowość, podajemy ją w nawiasie po nazwie metalu, np. wodorotlenek żelaza(II) – Fe(OH)2, wodorotlenek żelaza(III) – Fe(OH)3.
Zapamiętaj te podstawowe informacje – to fundament do dalszej nauki o wodorotlenkach!
Właściwości wodorotlenków: Co musisz wiedzieć na sprawdzian.
Właściwości wodorotlenków zależą od metalu, który wchodzi w ich skład. Ogólnie, możemy wyróżnić:
- Stan skupienia: W większości są to ciała stałe.
- Barwa: Barwa wodorotlenków jest różna, np. wodorotlenek sodu (NaOH) jest biały, wodorotlenek miedzi(II) (Cu(OH)2) jest niebieski.
- Rozpuszczalność w wodzie: Nie wszystkie wodorotlenki dobrze rozpuszczają się w wodzie. Te, które się rozpuszczają, nazywamy zasadami.
- Odczyn: Roztwory wodorotlenków mają odczyn zasadowy. Oznacza to, że powodują zmianę barwy wskaźników, np. fenoloftaleina barwi się na malinowo w środowisku zasadowym, a papierek uniwersalny zmienia kolor na niebieski lub fioletowy.
- Działanie żrące: Wiele wodorotlenków ma działanie żrące, dlatego należy zachować ostrożność podczas pracy z nimi.
Pamiętaj, że rozpuszczalność wodorotlenków w wodzie jest kluczowa. Tylko zasady (wodorotlenki rozpuszczalne w wodzie) reagują z kwasami, tworząc sól i wodę (reakcja zobojętniania).
"Wodorotlenki, zwłaszcza te rozpuszczalne, to potężne związki chemiczne. Zrozumienie ich właściwości to klucz do sukcesu na sprawdzianie!"
Przykłady wodorotlenków i ich właściwości:
- Wodorotlenek sodu (NaOH): Białe ciało stałe, bardzo dobrze rozpuszczalne w wodzie (zasada sodowa), silnie żrący. Używany w przemyśle chemicznym, papierniczym, włókienniczym i do produkcji mydła.
- Wodorotlenek potasu (KOH): Białe ciało stałe, dobrze rozpuszczalne w wodzie (zasada potasowa), silnie żrący. Podobne zastosowania jak NaOH.
- Wodorotlenek wapnia (Ca(OH)2): Biały proszek, słabo rozpuszczalny w wodzie (woda wapienna). Stosowany w budownictwie (jako składnik zaprawy murarskiej), rolnictwie (do odkwaszania gleby) i do produkcji wapna palonego.
- Wodorotlenek magnezu (Mg(OH)2): Biały proszek, praktycznie nierozpuszczalny w wodzie. Stosowany w medycynie jako środek zobojętniający kwas żołądkowy (np. mleczko magnezjowe).
- Wodorotlenek miedzi(II) (Cu(OH)2): Niebieski osad, nierozpuszczalny w wodzie. Powstaje podczas reakcji soli miedzi(II) z zasadami.
Otrzymywanie wodorotlenków: Jak powstają te związki?
Istnieje kilka sposobów otrzymywania wodorotlenków. Najważniejsze z nich to:
- Reakcja aktywnych metali z wodą: Metale z 1. i 2. grupy układu okresowego reagują z wodą, tworząc wodorotlenki i wodór. Na przykład: 2Na + 2H2O → 2NaOH + H2↑
- Reakcja tlenków metali z wodą: Tlenki metali reagują z wodą, tworząc wodorotlenki. Na przykład: CaO + H2O → Ca(OH)2
- Reakcja soli metali z zasadami: Reakcja ta prowadzi do powstania wodorotlenku, jeśli wodorotlenek ten jest nierozpuszczalny w wodzie (wypada osad). Na przykład: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Zwróć uwagę, że nie wszystkie metale reagują z wodą w ten sam sposób. Aktywność metali (czyli ich skłonność do reagowania) rośnie w dół w 1. grupie układu okresowego (lit, sód, potas, rubid, cez, frans). Potas reaguje z wodą gwałtowniej niż sód, a lit reaguje mniej gwałtownie niż sód. Metale z 2. grupy (beryl, magnez, wapń, stront, bar, rad) również reagują z wodą, ale reakcja zachodzi wolniej.
Reakcje chemiczne wodorotlenków: Co warto zapamiętać?
Wodorotlenki, a zwłaszcza zasady, uczestniczą w wielu ważnych reakcjach chemicznych. Najważniejsze z nich to:
- Reakcja zobojętniania: Reakcja wodorotlenku z kwasem, w wyniku której powstaje sól i woda. Na przykład: NaOH + HCl → NaCl + H2O
- Reakcja wodorotlenków z tlenkami kwasowymi: W wyniku tej reakcji powstaje sól i woda. Na przykład: 2NaOH + CO2 → Na2CO3 + H2O
- Reakcja wodorotlenków z solami: Reakcja ta zachodzi, jeśli powstaje osad (nierozpuszczalny wodorotlenek lub sól). Na przykład: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Pamiętaj o reakcji zobojętniania! To fundamentalna reakcja w chemii, w której kwas i zasada "neutralizują się", tworząc sól i wodę. Znajomość tej reakcji jest niezbędna do zrozumienia wielu procesów chemicznych i biologicznych.
Jak przygotować się do sprawdzianu z wodorotlenków? Praktyczne wskazówki.
Oto kilka praktycznych wskazówek, które pomogą Ci przygotować się do sprawdzianu z wodorotlenków:
- Powtórz definicję wodorotlenków i ich wzór ogólny. Upewnij się, że rozumiesz, co to jest grupa hydroksylowa (OH-) i jak wpływa ona na właściwości wodorotlenków.
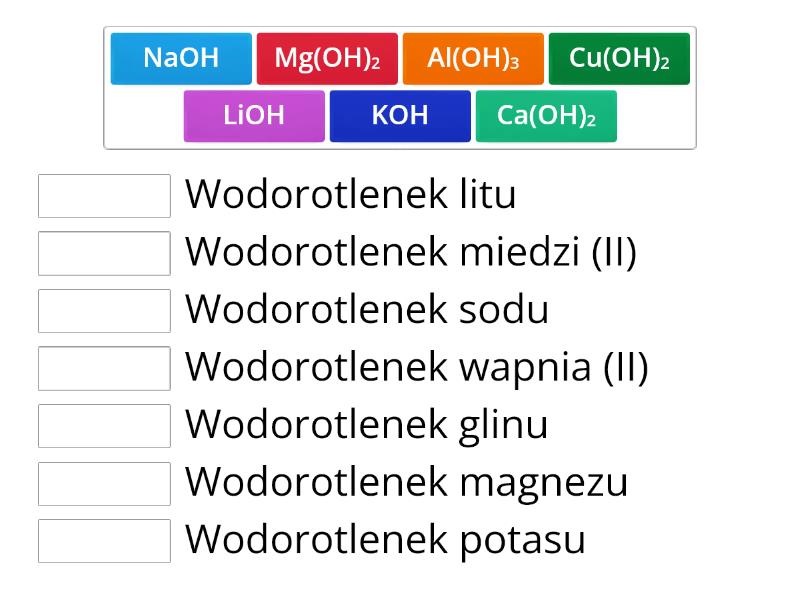
- Naucz się nazw i wzorów najważniejszych wodorotlenków. Wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH), wodorotlenek wapnia (Ca(OH)2), wodorotlenek magnezu (Mg(OH)2) – to musisz znać!
- Zrozum różnicę między wodorotlenkami a zasadami. Pamiętaj, że zasady to wodorotlenki rozpuszczalne w wodzie.
- Naucz się właściwości wodorotlenków i zasad. Jak wpływają na wskaźniki? Jak reagują z kwasami?
- Poznaj metody otrzymywania wodorotlenków. Jakie metale reagują z wodą? Jakie tlenki reagują z wodą?
- Przeprowadź reakcje chemiczne wodorotlenków. Zapisz równania reakcji zobojętniania, reakcji z tlenkami kwasowymi i reakcji z solami.
- Rozwiązuj zadania! Im więcej zadań rozwiążesz, tym lepiej utrwalisz wiedzę. Korzystaj z podręcznika, zbioru zadań, internetu.
- Zrób sobie kartkówki! Sprawdzaj swoją wiedzę regularnie, żeby zobaczyć, co jeszcze musisz powtórzyć.
- Poproś o pomoc! Jeśli czegoś nie rozumiesz, nie wstydź się zapytać nauczyciela, kolegów lub kogoś, kto dobrze zna chemię.
Pamiętaj, że regularna nauka i powtarzanie materiału to klucz do sukcesu. Nie zostawiaj wszystkiego na ostatnią chwilę! Ucz się systematycznie, a na sprawdzianie poczujesz się pewnie i spokojnie.
Przykładowe zadania na sprawdzian z odpowiedziami.
Sprawdź swoją wiedzę, rozwiązując poniższe zadania. Odpowiedzi znajdziesz na końcu.
- Napisz wzory sumaryczne następujących wodorotlenków: wodorotlenek sodu, wodorotlenek potasu, wodorotlenek wapnia, wodorotlenek żelaza(II), wodorotlenek żelaza(III).
- Wymień trzy sposoby otrzymywania wodorotlenków.
- Napisz równanie reakcji wodorotlenku sodu z kwasem solnym. Nazwij produkty tej reakcji.
- Jakiego koloru staje się fenoloftaleina w roztworze wodorotlenku potasu?
- Który z wymienionych wodorotlenków jest używany w budownictwie do produkcji zaprawy murarskiej: wodorotlenek sodu, wodorotlenek potasu, wodorotlenek wapnia, wodorotlenek magnezu?
Odpowiedzi:
- NaOH, KOH, Ca(OH)2, Fe(OH)2, Fe(OH)3
- Reakcja aktywnych metali z wodą, reakcja tlenków metali z wodą, reakcja soli metali z zasadami.
- NaOH + HCl → NaCl + H2O. Produkty: chlorek sodu (sól) i woda.
- Malinowy
- Wodorotlenek wapnia
Mamy nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć wodorotlenki i przygotować się do sprawdzianu. Pamiętaj, że chemia może być fascynująca! Wystarczy trochę wysiłku i chęci, żeby ją polubić. Powodzenia na sprawdzianie!