Sprawdzian Woda I Roztwory Wodne Klasa 7

W klasie 7, temat Woda i Roztwory Wodne to fundament chemii. Zrozumienie właściwości wody, jej roli jako rozpuszczalnika, oraz procesów związanych z tworzeniem roztworów, jest kluczowe do dalszej nauki o substancjach i reakcjach chemicznych. Ten artykuł ma za zadanie kompleksowo omówić najważniejsze aspekty tego zagadnienia, aby ułatwić przygotowanie do sprawdzianu.
Właściwości Wody – Niezwykła Substancja
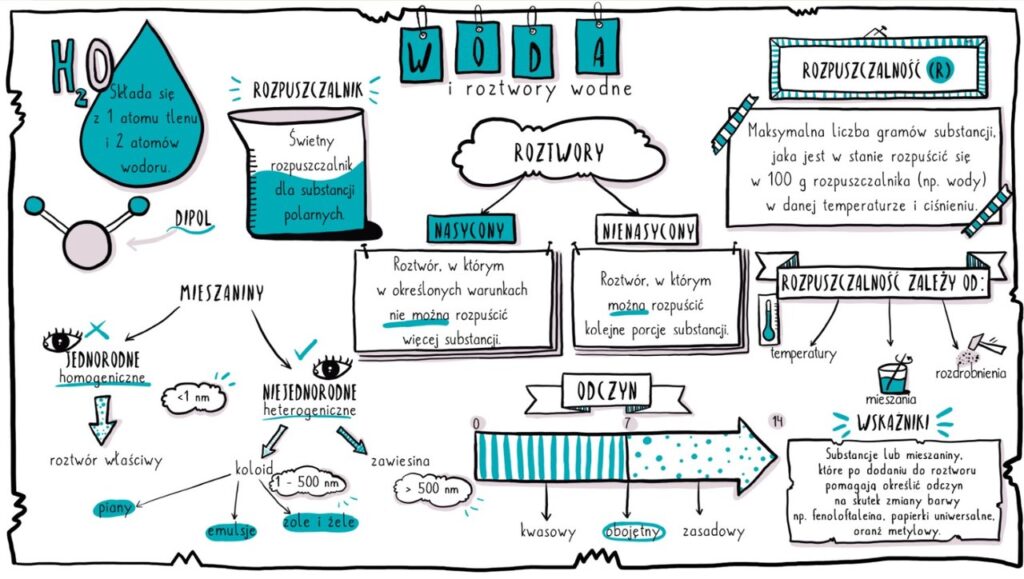
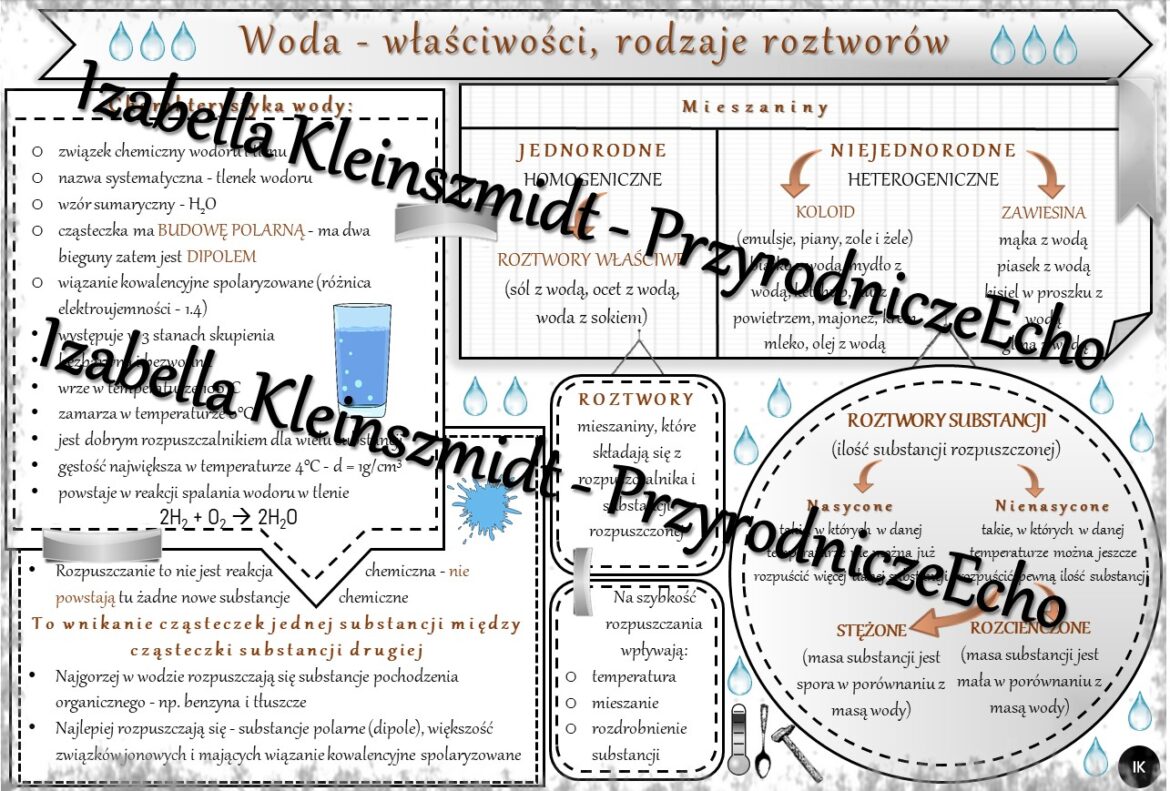
Woda, o wzorze chemicznym H2O, jest substancją o wyjątkowych właściwościach, które odróżniają ją od wielu innych związków. Jej cząsteczka składa się z dwóch atomów wodoru i jednego atomu tlenu, połączonych wiązaniami kowalencyjnymi spolaryzowanymi.
Polarność Cząsteczki Wody
Kluczową cechą wody jest jej polarność. Atom tlenu przyciąga elektrony silniej niż atom wodoru, co prowadzi do powstania częściowego ładunku ujemnego na atomie tlenu i częściowych ładunków dodatnich na atomach wodoru. Ta różnica w ładunkach powoduje, że cząsteczka wody ma biegun dodatni i biegun ujemny. Dzięki temu woda jest dobrym rozpuszczalnikiem dla substancji polarnych i jonowych.
Wiązania Wodorowe
Polarność wody umożliwia tworzenie się wiązań wodorowych między cząsteczkami. Atom wodoru z jednej cząsteczki wody jest przyciągany przez atom tlenu innej cząsteczki. Wiązania wodorowe, choć słabsze od wiązań kowalencyjnych, mają ogromny wpływ na właściwości wody, takie jak wysokie napięcie powierzchniowe, wysokie ciepło właściwe i wysoka temperatura wrzenia.
Przykładowo: Dzięki wiązaniom wodorowym owady mogą chodzić po powierzchni wody, a organizmy wodne są chronione przed gwałtownymi zmianami temperatury.
Napięcie Powierzchniowe Wody
Napięcie powierzchniowe to siła, która powoduje, że powierzchnia wody zachowuje się jak cienka błona. Jest to spowodowane silnymi siłami spójności między cząsteczkami wody na powierzchni, wynikającymi z wiązań wodorowych. Napięcie powierzchniowe ma istotne znaczenie dla transportu wody w roślinach (kapilarność) i dla życia organizmów wodnych.
Przykład: Kropelki wody mają tendencję do przyjmowania kulistego kształtu, co minimalizuje powierzchnię i maksymalizuje siły spójności między cząsteczkami.
Roztwory Wodne – Mieszaniny Jednorodne
Roztwór to jednorodna mieszanina dwóch lub więcej substancji. W przypadku roztworów wodnych, woda pełni rolę rozpuszczalnika, a druga substancja (lub substancje) jest substancją rozpuszczoną.
Proces Rozpuszczania
Proces rozpuszczania polega na dyspergowaniu substancji rozpuszczonej w rozpuszczalniku na poziomie molekularnym lub jonowym. W przypadku substancji polarnych i jonowych, cząsteczki wody otaczają jony lub cząsteczki substancji rozpuszczonej, osłabiając siły przyciągania między nimi i umożliwiając ich rozproszenie w wodzie. Ten proces nazywa się solwatacją lub hydratacją (gdy rozpuszczalnikiem jest woda).
Na przykład: Rozpuszczanie soli kuchennej (NaCl) w wodzie. Jony sodu (Na+) i chlorku (Cl-) są otaczane przez cząsteczki wody, które neutralizują ich ładunki i zapobiegają ich ponownemu łączeniu się w kryształ.
Rodzaje Roztworów
- Roztwory nienasycone: Roztwory, w których można rozpuścić więcej substancji rozpuszczonej w danej temperaturze.
- Roztwory nasycone: Roztwory, w których w danej temperaturze nie można rozpuścić więcej substancji rozpuszczonej. Dodanie kolejnej porcji substancji rozpuszczonej spowoduje jej osadzenie się na dnie naczynia.
- Roztwory przesycone: Roztwory, które zawierają więcej substancji rozpuszczonej niż roztwór nasycony w danej temperaturze. Są to roztwory nietrwałe i mogą się krystalizować po dodaniu kryształka substancji rozpuszczonej lub po wstrząśnięciu.
Rozpuszczalność Substancji
Rozpuszczalność to maksymalna ilość substancji, którą można rozpuścić w danej ilości rozpuszczalnika w określonej temperaturze. Rozpuszczalność zależy od wielu czynników, takich jak:
- Rodzaj substancji rozpuszczonej i rozpuszczalnika: Zasadą jest, że "podobne rozpuszcza się w podobnym". Substancje polarne dobrze rozpuszczają się w rozpuszczalnikach polarnych (np. woda), a substancje niepolarne dobrze rozpuszczają się w rozpuszczalnikach niepolarnych (np. benzyna).
- Temperatura: Zazwyczaj rozpuszczalność substancji stałych w wodzie rośnie wraz ze wzrostem temperatury. Natomiast rozpuszczalność gazów w wodzie maleje wraz ze wzrostem temperatury.
- Ciśnienie: Ciśnienie ma istotny wpływ na rozpuszczalność gazów w cieczach. Zgodnie z prawem Henry'ego, rozpuszczalność gazu w cieczy jest wprost proporcjonalna do ciśnienia parcjalnego tego gazu nad cieczą.
Przykład: Cukier rozpuszcza się lepiej w gorącej wodzie niż w zimnej. Napoje gazowane zawierają rozpuszczony dwutlenek węgla pod ciśnieniem. Po otwarciu butelki ciśnienie maleje, a dwutlenek węgla uwalnia się z roztworu, powodując powstawanie bąbelków.
Stężenie Roztworów
Stężenie roztworu to ilość substancji rozpuszczonej zawarta w określonej ilości roztworu lub rozpuszczalnika. Istnieje kilka sposobów wyrażania stężenia roztworów:
Stężenie Procentowe Masowe (Cp)
Stężenie procentowe masowe (Cp) to masa substancji rozpuszczonej wyrażona w gramach, zawarta w 100 gramach roztworu. Oblicza się je ze wzoru:
Cp = (ms / mr) * 100%
gdzie:
- ms - masa substancji rozpuszczonej (g)
- mr - masa roztworu (g)
Przykład: Roztwór 10% oznacza, że w 100g roztworu znajduje się 10g substancji rozpuszczonej.
Stężenie Molowe (Cm)
Stężenie molowe (Cm) to liczba moli substancji rozpuszczonej zawarta w 1 dm3 (litrze) roztworu. Oblicza się je ze wzoru:
Cm = n / V
gdzie:
- n - liczba moli substancji rozpuszczonej (mol)
- V - objętość roztworu (dm3)
Przykład: Roztwór 1 molowy (1M) oznacza, że w 1 litrze roztworu znajduje się 1 mol substancji rozpuszczonej.
Obliczenia Związane ze Stężeniami
W zadaniach dotyczących stężeń często spotyka się obliczenia związane z rozcieńczaniem i zatężaniem roztworów. Ważne jest, aby pamiętać o zasadzie zachowania masy substancji rozpuszczonej:
Masa substancji rozpuszczonej przed rozcieńczeniem = Masa substancji rozpuszczonej po rozcieńczeniu
Podobnie, przy mieszaniu dwóch roztworów:
Masa substancji rozpuszczonej w roztworze A + Masa substancji rozpuszczonej w roztworze B = Masa substancji rozpuszczonej w roztworze wynikowym
Znaczenie Wody i Roztworów Wodnych w Życiu
Woda i roztwory wodne odgrywają kluczową rolę w wielu aspektach naszego życia:
- Biologia: Woda stanowi główny składnik organizmów żywych i środowisko, w którym zachodzą procesy biologiczne. Roztwory wodne transportują składniki odżywcze, tlen i odprowadzają produkty przemiany materii.
- Chemia: Woda jest uniwersalnym rozpuszczalnikiem, niezbędnym w wielu reakcjach chemicznych. Roztwory wodne są powszechnie stosowane w laboratoriach i przemyśle.
- Przemysł: Woda jest wykorzystywana w wielu procesach przemysłowych, np. jako chłodziwo, rozpuszczalnik, surowiec do produkcji innych substancji.
- Życie codzienne: Woda jest niezbędna do picia, gotowania, utrzymania higieny osobistej i czystości w domu. Roztwory wodne, takie jak napoje, soki, zupy, są powszechnie spożywane.
Dane: Około 60-70% masy ciała człowieka stanowi woda. Zapotrzebowanie na wodę zależy od wieku, aktywności fizycznej i warunków klimatycznych, ale średnio wynosi około 2-3 litrów dziennie.
Podsumowanie
Zrozumienie właściwości wody i roztworów wodnych jest fundamentalne dla dalszej nauki chemii i biologii. Znajomość polarności cząsteczki wody, wiązań wodorowych, procesu rozpuszczania, rodzajów roztworów oraz sposobów wyrażania stężenia roztworów pozwoli Ci na skuteczne przygotowanie do sprawdzianu. Pamiętaj o rozwiązywaniu zadań praktycznych, aby utrwalić zdobytą wiedzę.
Działaj! Przejrzyj swoje notatki z lekcji, rozwiąż kilka zadań z podręcznika i spróbuj wyjaśnić komuś innemu omawiane zagadnienia. W ten sposób najlepiej utrwalisz swoją wiedzę i poczujesz się pewnie przed sprawdzianem. Powodzenia!