Sprawdzian Chemia Wodorotlenki A Zasady
Czy zbliża się sprawdzian z chemii dotyczący wodorotlenków i zasad i czujesz lekki niepokój? Nie martw się! Ten artykuł został stworzony właśnie dla Ciebie, aby pomóc Ci zrozumieć kluczowe zagadnienia, powtórzyć materiał i poczuć się pewniej przed klasówką. Naszym celem jest dostarczenie Ci klarownego i przystępnego przewodnika po świecie wodorotlenków i zasad, z uwzględnieniem najważniejszych definicji, właściwości, reakcji i zastosowań.
Co znajdziesz w tym artykule?
Ten artykuł jest skierowany do uczniów szkół podstawowych i ponadpodstawowych, którzy przygotowują się do sprawdzianu z chemii obejmującego wodorotlenki i zasady. Znajdziesz tutaj:
- Wyjaśnienie podstawowych pojęć: czym są wodorotlenki i zasady?
- Omówienie budowy i nazewnictwa wodorotlenków.
- Charakterystykę właściwości fizycznych i chemicznych wodorotlenków.
- Przykłady reakcji chemicznych z udziałem wodorotlenków.
- Informacje o zastosowaniach wodorotlenków w życiu codziennym i przemyśle.
- Wskazówki, jak radzić sobie z typowymi zadaniami na sprawdzianie.
Postaramy się przedstawić te zagadnienia w sposób zrozumiały i zapadający w pamięć, wykorzystując przykłady z życia codziennego i proste schematy.
Wodorotlenki: Podstawowe definicje
Zacznijmy od podstaw. Czym właściwie są wodorotlenki? Najprościej mówiąc, są to związki chemiczne, które w swojej budowie zawierają grupę wodorotlenową, o wzorze -OH, związaną z metalem (najczęściej metalem grupy I lub II układu okresowego) lub z grupą amonową (NH4+).
Ogólny wzór wodorotlenku to M(OH)n, gdzie:
- M oznacza metal (lub grupę amonową).
- OH oznacza grupę wodorotlenową.
- n oznacza wartościowość metalu (lub grupy amonowej).
Przykłady wodorotlenków:
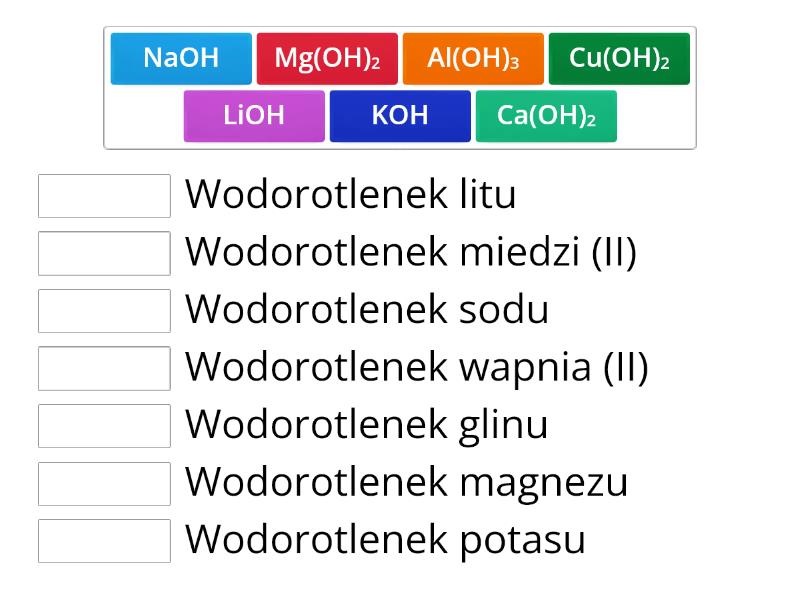
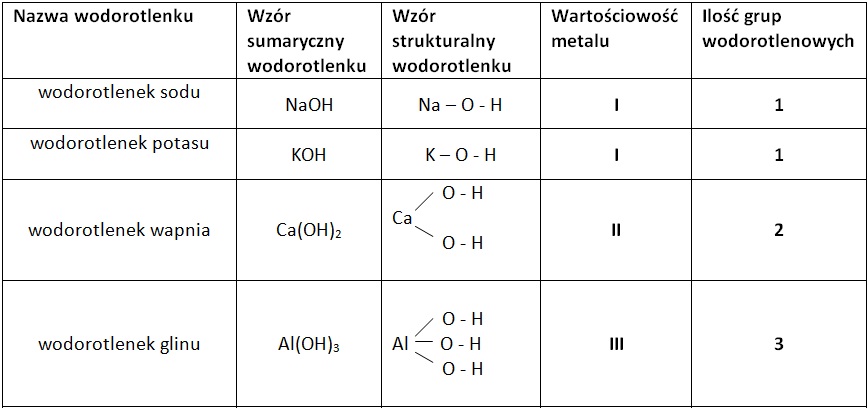
- Wodorotlenek sodu: NaOH (popularny soda kaustyczna lub ług sodowy)
- Wodorotlenek potasu: KOH (potaż żrący)
- Wodorotlenek wapnia: Ca(OH)2 (wapno gaszone)
- Wodorotlenek magnezu: Mg(OH)2 (znajdujący się w niektórych lekach na zgagę)
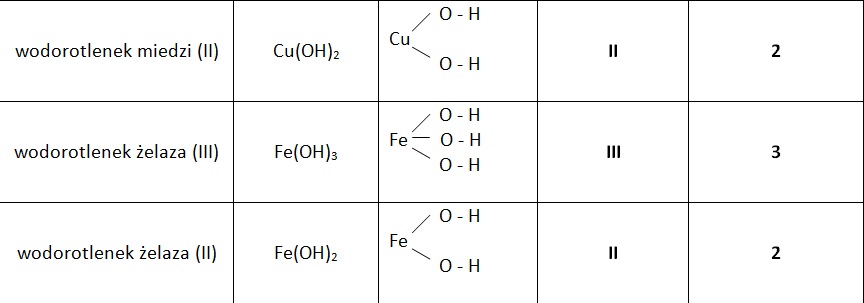
Nazewnictwo Wodorotlenków
Jak nazwać wodorotlenek? Nazwa wodorotlenku składa się z dwóch członów: "wodorotlenek" i nazwy metalu (lub grupy amonowej) z podaniem jego wartościowości, jeśli metal tworzy więcej niż jeden wodorotlenek. Na przykład:
- NaOH: wodorotlenek sodu
- KOH: wodorotlenek potasu
- Fe(OH)2: wodorotlenek żelaza(II)
- Fe(OH)3: wodorotlenek żelaza(III)
Zauważ, że w przypadku żelaza, które ma dwie możliwe wartościowości (II i III), konieczne jest podanie wartościowości w nawiasie, aby odróżnić te dwa związki.
Właściwości Wodorotlenków
Właściwości fizyczne
Właściwości fizyczne wodorotlenków zależą od rodzaju metalu, z którym związana jest grupa wodorotlenowa. Zazwyczaj są to:
- Substancje stałe o budowie krystalicznej.
- Barwa: najczęściej białe lub bezbarwne.
- Większość dobrze rozpuszcza się w wodzie (tworząc zasady), niektóre słabo lub wcale.
- Wodorotlenki metali alkalicznych (LiOH, NaOH, KOH) są higroskopijne (pochłaniają wilgoć z otoczenia).
Właściwości chemiczne
To właśnie właściwości chemiczne wodorotlenków decydują o ich znaczeniu. Najważniejsze z nich to:
- Odczyn zasadowy: Roztwory wodorotlenków w wodzie mają odczyn zasadowy, co oznacza, że pH jest większe niż 7.
- Reakcja z kwasami: Wodorotlenki reagują z kwasami, tworząc sól i wodę (reakcja zobojętniania).
Na przykład: NaOH + HCl → NaCl + H2O
- Reakcja z tlenkami kwasowymi: Wodorotlenki reagują z tlenkami kwasowymi, tworząc sól i (często) wodę.
Na przykład: 2NaOH + CO2 → Na2CO3 + H2O
- Reakcja z solami: Niektóre wodorotlenki reagują z solami, tworząc inne wodorotlenki i sole.
Na przykład: 2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4 (powstaje osad wodorotlenku miedzi(II))
- Działanie żrące: Silne zasady, takie jak NaOH i KOH, są żrące i mogą powodować poważne oparzenia skóry i uszkodzenia oczu.
Zasady: Wodorotlenki Rozpuszczalne w Wodzie
Zasady to wodorotlenki, które dobrze rozpuszczają się w wodzie. W roztworze wodnym dysocjują na jony metalu (lub grupy amonowej) i jony wodorotlenkowe (OH-). Obecność jonów OH- powoduje, że roztwór ma odczyn zasadowy.
Do najważniejszych zasad należą:
- Wodorotlenek sodu (NaOH)
- Wodorotlenek potasu (KOH)
- Wodorotlenek litu (LiOH)
- Wodorotlenek baru (Ba(OH)2)
- Wodorotlenek wapnia (Ca(OH)2) – choć słabo rozpuszczalny, jego roztwór wodny (woda wapienna) ma właściwości zasadowe.
Wskaźniki Kwasowo-Zasadowe
Wskaźniki kwasowo-zasadowe to substancje, które zmieniają kolor w zależności od pH roztworu. Używa się ich do określania odczynu roztworu (kwasowy, zasadowy, obojętny). Najpopularniejsze wskaźniki to:
- Papier uniwersalny: Impregnowany mieszaniną wskaźników, zmienia kolor w zależności od pH.
- Fenoloftaleina: Bezbarwna w roztworach kwasowych i obojętnych, malinowa w roztworach zasadowych.
- Oranż metylowy: Czerwony w roztworach kwasowych, pomarańczowy w roztworach obojętnych, żółty w roztworach zasadowych.
- Lakmus: Czerwony w roztworach kwasowych, niebieski w roztworach zasadowych.
Znając kolory wskaźników w roztworach o różnym pH, możemy łatwo zidentyfikować, czy dana substancja ma charakter kwasowy, zasadowy czy obojętny.
Zastosowania Wodorotlenków i Zasad
Wodorotlenki i zasady znajdują szerokie zastosowanie w różnych dziedzinach:
- Przemysł chemiczny: W produkcji mydeł, detergentów, papieru, włókien sztucznych, leków, barwników.
- Oczyszczanie ścieków: Do neutralizacji kwasów i usuwania metali ciężkich.
- Budownictwo: Wapno gaszone (Ca(OH)2) jest składnikiem zapraw murarskich i tynków.
- Rolnictwo: Wapno nawozowe (Ca(OH)2) służy do odkwaszania gleby.
- Farmacja: Wodorotlenek magnezu (Mg(OH)2) jest składnikiem leków na zgagę.
- Gospodarstwo domowe: Soda kaustyczna (NaOH) jest stosowana do udrażniania rur kanalizacyjnych.
Jak widzisz, wodorotlenki i zasady odgrywają ważną rolę w naszym życiu, zarówno w przemyśle, jak i w życiu codziennym.
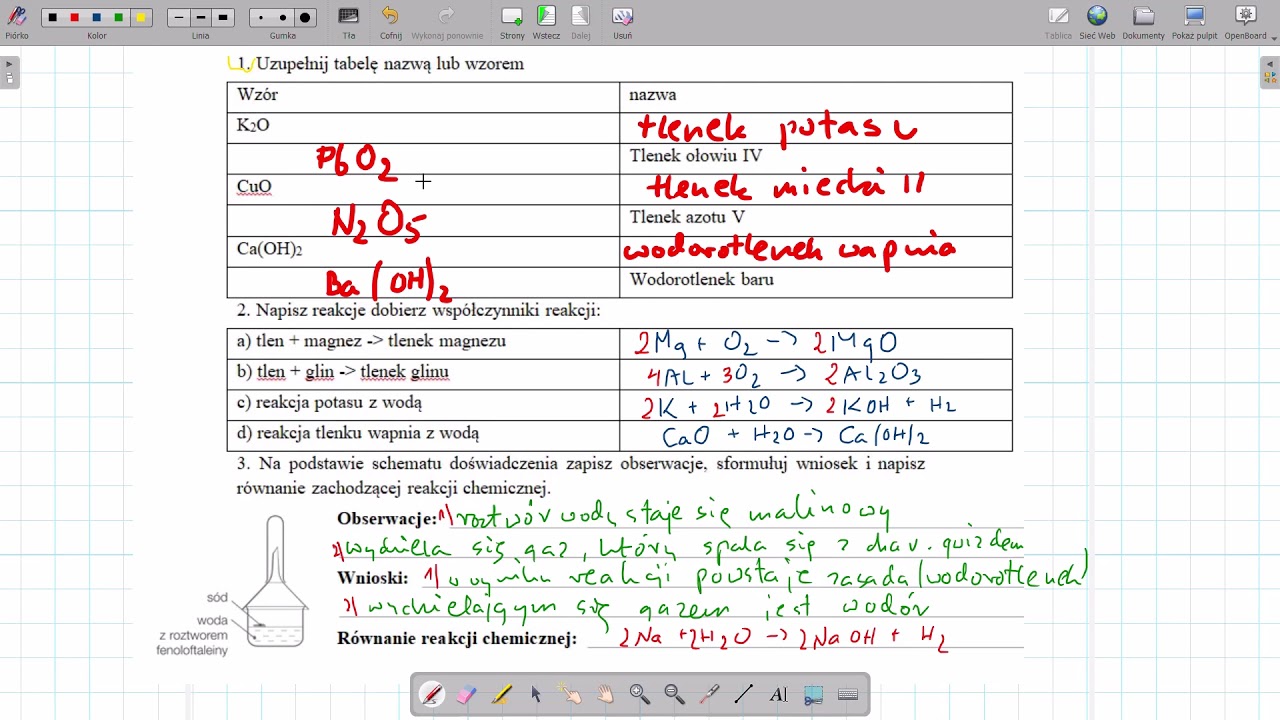
Przykłady Zadań na Sprawdzianie
Przygotowując się do sprawdzianu, warto przećwiczyć rozwiązywanie typowych zadań. Oto kilka przykładów:
- Napisz wzory sumaryczne i nazwy następujących wodorotlenków: wodorotlenek potasu, wodorotlenek wapnia, wodorotlenek żelaza(III).
- Zaznacz, które z poniższych substancji to zasady: NaCl, KOH, HCl, Ca(OH)2, H2SO4.
- Uzupełnij równania reakcji:
- NaOH + H2SO4 → ... + ...
- Ca(OH)2 + CO2 → ... + ...
- Określ odczyn roztworu, w którym papier uniwersalny zabarwił się na niebiesko.
- Wyjaśnij, dlaczego wodorotlenek sodu jest substancją żrącą.
Rozwiązując te i podobne zadania, utrwalisz wiedzę i zdobędziesz pewność siebie przed sprawdzianem.
Wskazówki na Sprawdzian
Na koniec kilka praktycznych wskazówek, które pomogą Ci dobrze wypaść na sprawdzianie:
- Przeczytaj uważnie polecenia. Zwróć uwagę na to, o co dokładnie pytają.
- Pisz czytelnie. Upewnij się, że nauczyciel może bez problemu odczytać Twoje odpowiedzi.
- Używaj poprawnej terminologii chemicznej. Unikaj skrótów i uproszczeń.
- Sprawdzaj swoje odpowiedzi. Zanim oddasz sprawdzian, upewnij się, że nie popełniłeś żadnych błędów.
- Nie panikuj! Jeśli nie wiesz, jak rozwiązać jakieś zadanie, spróbuj przypomnieć sobie podobne zadania, które rozwiązywałeś wcześniej.
Pamiętaj, że solidna wiedza i pozytywne nastawienie to klucz do sukcesu na sprawdzianie z chemii. Powodzenia!
Podsumowanie
Mamy nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć zagadnienia związane z wodorotlenkami i zasadami. Pamiętaj, że kluczem do sukcesu jest regularna nauka, rozwiązywanie zadań i zadawanie pytań, jeśli coś jest niejasne. Chemia może być fascynująca, a zrozumienie podstawowych pojęć, takich jak wodorotlenki i zasady, otworzy Ci drzwi do dalszej eksploracji tego fascynującego świata. Teraz możesz z pewnością przystąpić do sprawdzianu z chemii! Powodzenia!