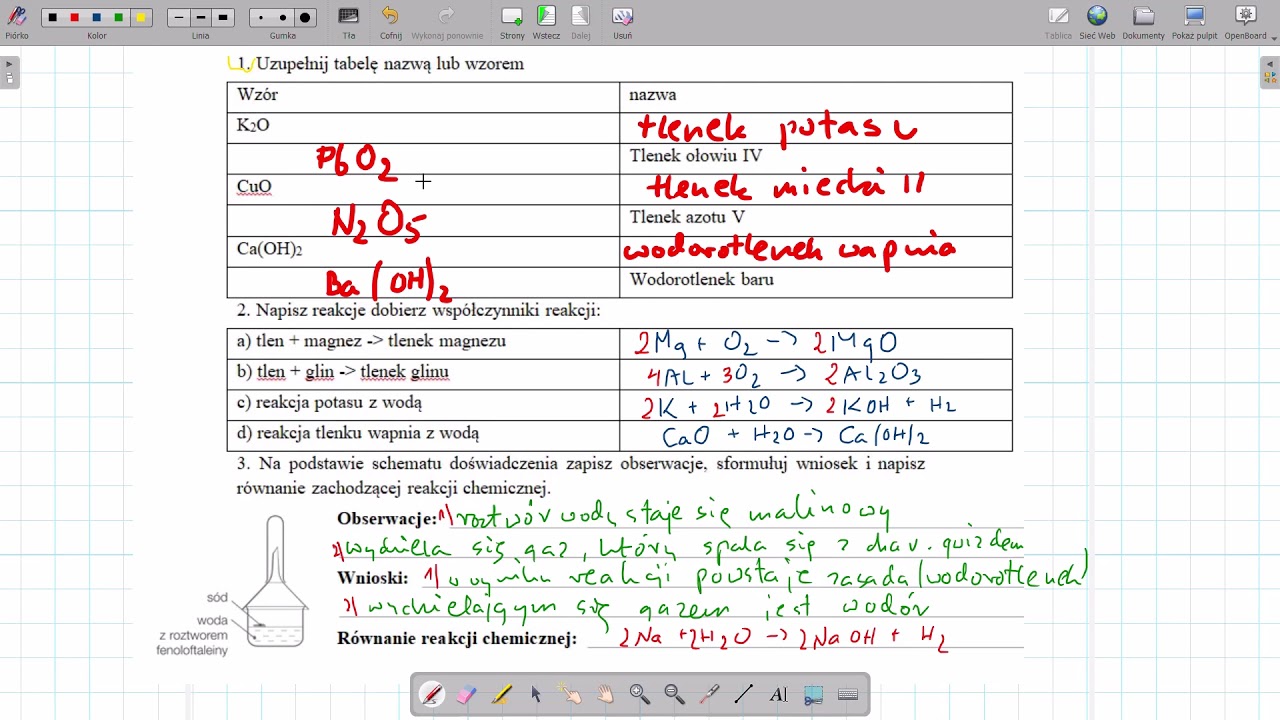
Sprawdzian Chemia Nowa Era Klasa 2 Wodorotlenki

Wodorotlenki to związki chemiczne, które zawierają grupę wodorotlenową (-OH) związaną z atomem metalu lub grupą amonową (NH4+). Generalny wzór wodorotlenku metalu to M(OH)n, gdzie M oznacza metal o wartościowości n.
Kluczowe aspekty wodorotlenków obejmują:
Budowa: Charakteryzują się obecnością wiązania jonowego między kationem metalu a anionem wodorotlenkowym (-OH)-.
Nazewnictwo: Nazwa wodorotlenku składa się z członu "wodorotlenek" i nazwy metalu, z uwzględnieniem jego wartościowości (jeśli metal tworzy wodorotlenki o różnej wartościowości, np. wodorotlenek żelaza(II) - Fe(OH)2 i wodorotlenek żelaza(III) - Fe(OH)3).
Właściwości: Wodorotlenki metali alkalicznych i metali ziem alkalicznych (np. NaOH, KOH, Ca(OH)2) są rozpuszczalne w wodzie i tworzą zasady. Inne wodorotlenki, np. wodorotlenek glinu (Al(OH)3), są nierozpuszczalne w wodzie i mają charakter amfoteryczny.
Dysocjacja: Rozpuszczalne wodorotlenki dysocjują w wodzie na kation metalu i aniony wodorotlenkowe, podnosząc pH roztworu.
Przykłady:
Wodorotlenek sodu (NaOH) – silna zasada, używana w przemyśle do produkcji mydła, papieru i aluminium.
Wodorotlenek wapnia (Ca(OH)2) – znany jako wapno gaszone, stosowany w budownictwie i rolnictwie do odkwaszania gleby.
Wodorotlenki mają szerokie zastosowanie w przemyśle chemicznym, budownictwie, rolnictwie i oczyszczaniu ścieków. Wykorzystywane są jako reagenty, neutralizatory kwasów i składniki wielu produktów.

![Sprawdzian Chemia Nowa Era Klasa 2 Wodorotlenki Otrzymywanie wodorotlenków #7 [ Kwasy i wodorotlenki ] - YouTube](https://i.ytimg.com/vi/TAYcifqfJ2Y/maxresdefault.jpg)
![Sprawdzian Chemia Nowa Era Klasa 2 Wodorotlenki SPRAWDZIAN Chemia. Klasa 7: Tlenki i wodorotlenki [5] - YouTube](https://i.ytimg.com/vi/lB-CSds7Eik/maxresdefault.jpg?sqp=-oaymwEmCIAKENAF8quKqQMa8AEB-AH-CYAC0AWKAgwIABABGGUgZShlMA8=&rs=AOn4CLBHWE0z9H8yRycaPTPRqUIQ2BXF2A)
