Sprawdzian Chemia Klasa 8 Wodorotlenki Grupa C

Sprawdzian z chemii w klasie 8, szczególnie ten dotyczący wodorotlenków (grupa C), to dla wielu uczniów wyzwanie. Zrozumienie natury wodorotlenków, ich właściwości oraz zastosowań jest kluczowe do pomyślnego zdania tego testu. Ten artykuł ma na celu pomóc w przygotowaniu się do sprawdzianu, omawiając najważniejsze aspekty tej grupy związków chemicznych.
Czym są wodorotlenki?
Wodorotlenki to związki chemiczne, które w swojej cząsteczce zawierają grupę hydroksylową (-OH) połączoną z atomem metalu. Generalny wzór wodorotlenku to M(OH)n, gdzie M to metal, a n to jego wartościowość. Grupa hydroksylowa decyduje o charakterystycznych właściwościach tych związków.
Właściwości charakterystyczne wodorotlenków
Właściwości wodorotlenków wynikają głównie z obecności grupy OH. Do najważniejszych cech należą:
- Odczyn zasadowy: Wodorotlenki w roztworach wodnych wykazują odczyn zasadowy, co oznacza, że podwyższają pH roztworu. pH powyżej 7 wskazuje na roztwór zasadowy.
- Reakcja z kwasami (neutralizacja): Wodorotlenki reagują z kwasami, tworząc sól i wodę. Jest to reakcja neutralizacji: wodorotlenek + kwas → sól + woda.
- Działanie żrące: Silne wodorotlenki, takie jak wodorotlenek sodu (NaOH) czy wodorotlenek potasu (KOH), mają działanie żrące na skórę i inne materiały organiczne.
- Rozpuszczalność w wodzie: Nie wszystkie wodorotlenki są dobrze rozpuszczalne w wodzie. Rozpuszczalność zależy od rodzaju metalu, z którym związana jest grupa hydroksylowa.
Nazewnictwo wodorotlenków
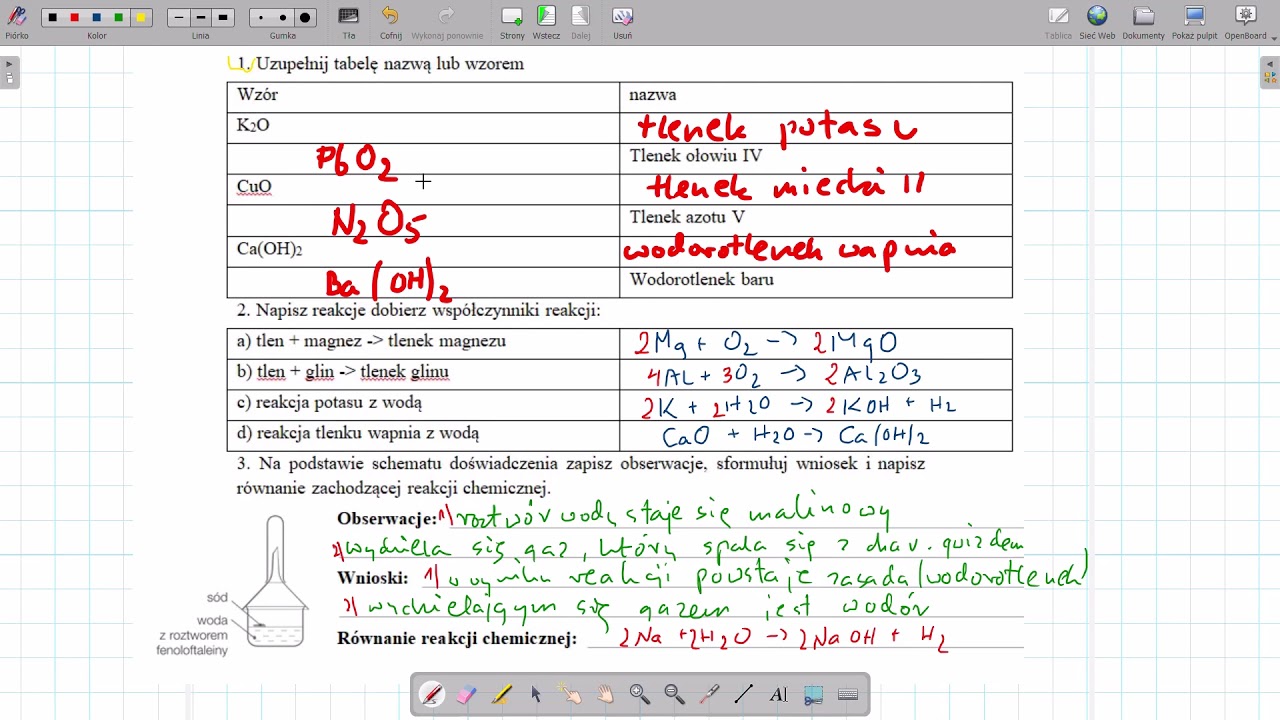
Nazwy wodorotlenków tworzy się, dodając słowo "wodorotlenek" do nazwy metalu, który tworzy dany wodorotlenek. Jeżeli metal występuje w kilku stopniach utlenienia, to po nazwie metalu, w nawiasie, podaje się jego wartościowość cyframi rzymskimi. Przykłady:
- NaOH – Wodorotlenek sodu
- KOH – Wodorotlenek potasu
- Ca(OH)2 – Wodorotlenek wapnia
- Fe(OH)2 – Wodorotlenek żelaza(II)
- Fe(OH)3 – Wodorotlenek żelaza(III)
Otrzymywanie wodorotlenków
Wodorotlenki można otrzymywać różnymi metodami. Dwie najpopularniejsze to:
- Reakcja metalu z wodą: Niektóre metale, szczególnie metale alkaliczne (np. sód, potas) i metale ziem alkalicznych (np. wapń), reagują z wodą, tworząc wodorotlenek i wodór: metal + woda → wodorotlenek + wodór. Na przykład: 2Na + 2H2O → 2NaOH + H2.
- Reakcja tlenku metalu z wodą: Tlenki metali, szczególnie tlenki metali alkalicznych i ziem alkalicznych, reagują z wodą, tworząc wodorotlenki: tlenek metalu + woda → wodorotlenek. Na przykład: CaO + H2O → Ca(OH)2.
Przykłady wodorotlenków i ich zastosowania
Wodorotlenki mają szerokie zastosowanie w różnych dziedzinach. Oto kilka przykładów:
- Wodorotlenek sodu (NaOH): Znany również jako soda kaustyczna. Używany w przemyśle chemicznym, papierniczym, mydlarskim i włókienniczym. Służy do produkcji mydła, detergentów, papieru oraz do oczyszczania ścieków.
- Wodorotlenek potasu (KOH): Podobnie jak wodorotlenek sodu, stosowany w produkcji mydeł (mydła potasowe są bardziej miękkie niż mydła sodowe), elektrolitu w akumulatorach alkalicznych oraz w laboratoriach chemicznych.
- Wodorotlenek wapnia (Ca(OH)2): Znany jako wapno gaszone. Używany w budownictwie do przygotowywania zapraw murarskich, w rolnictwie do odkwaszania gleby oraz w przemyśle spożywczym.
- Wodorotlenek magnezu (Mg(OH)2): Stosowany jako lek zobojętniający kwas żołądkowy (antacid) oraz jako środek przeczyszczający.
Wodorotlenek glinu (Al(OH)3): Używany w produkcji kosmetyków, farmaceutyków (jako adiuwant w szczepionkach) oraz jako substancja wiążąca w produkcji papieru. Badania wykazały, że adiuwanty glinowe wzmacniają odpowiedź immunologiczną na szczepionki, co zwiększa ich skuteczność.
Reakcje charakterystyczne i identyfikacja wodorotlenków
Jedną z charakterystycznych reakcji wodorotlenków jest ich reakcja z fenoloftaleiną. Fenoloftaleina jest wskaźnikiem pH, który w roztworach zasadowych (czyli w obecności wodorotlenków) zmienia barwę na malinową. Ta reakcja jest często wykorzystywana do identyfikacji wodorotlenków w laboratorium.
Podsumowanie i przygotowanie do sprawdzianu
Aby dobrze przygotować się do sprawdzianu z chemii (klasa 8, wodorotlenki, grupa C), należy przede wszystkim zrozumieć podstawowe definicje, wzory i właściwości wodorotlenków. Ważne jest, aby znać nazewnictwo wodorotlenków, umieć pisać równania reakcji otrzymywania wodorotlenków i neutralizacji. Zapamiętaj przykłady zastosowań poszczególnych wodorotlenków. Rozwiąż jak najwięcej zadań i ćwiczeń dotyczących wodorotlenków. Powodzenia!
![Sprawdzian Chemia Klasa 8 Wodorotlenki Grupa C SPRAWDZIAN Chemia. Klasa 7: Tlenki i wodorotlenki [5] - YouTube](https://i.ytimg.com/vi/lB-CSds7Eik/maxresdefault.jpg?sqp=-oaymwEmCIAKENAF8quKqQMa8AEB-AH-CYAC0AWKAgwIABABGGUgZShlMA8=&rs=AOn4CLBHWE0z9H8yRycaPTPRqUIQ2BXF2A)



