Sprawdzian Chemia Klasa 7 łączenie Się Atomów Równania Reakcji Chemicznych

Dobrze, przygotujcie się, bo zanurkujemy głęboko w temat wiązania się atomów i równań reakcji chemicznych, kluczowych zagadnień na sprawdzian z chemii w klasie 7. Postaram się przedstawić to tak szczegółowo, jak tylko się da.
Zaczynamy od fundamentów: atomów. Pamiętajcie, że atom nie jest niepodzielną kulką, ale składa się z jądra (protony i neutrony) i elektronów krążących wokół jądra na różnych powłokach. To właśnie elektrony, a konkretnie elektrony walencyjne (te na najbardziej zewnętrznej powłoce), decydują o tym, jak atom będzie się łączył z innymi atomami.
Dążenie do oktetu elektronowego (czyli posiadania 8 elektronów na ostatniej powłoce – z wyjątkiem wodoru i helu, które dążą do duetu) jest motorem napędowym powstawania wiązań chemicznych. Atomy „chcą” być jak gazy szlachetne, które są bardzo stabilne właśnie dzięki temu, że mają zapełnioną powłokę walencyjną.
Rodzaje Wiązań Chemicznych
Mamy kilka głównych rodzajów wiązań, które musimy opanować.
-
Wiązanie jonowe: Powstaje, gdy jeden atom oddaje elektron(y) drugiemu atomowi. Atom, który oddaje elektrony, staje się kationem (jonem dodatnim), a atom, który przyjmuje elektrony, staje się anionem (jonem ujemnym). Te przeciwnie naładowane jony przyciągają się elektrostatycznie, tworząc wiązanie jonowe. Klasycznym przykładem jest chlorek sodu (NaCl). Sód (Na) oddaje elektron chlorowi (Cl), tworząc Na+ i Cl-. Pamiętajcie, że związki jonowe tworzą zazwyczaj kryształy, a ich roztwory wodne przewodzą prąd elektryczny (są elektrolitami). Siła wiązania jonowego zależy od ładunków jonów i odległości między nimi – im większe ładunki i mniejsza odległość, tym silniejsze wiązanie.
-
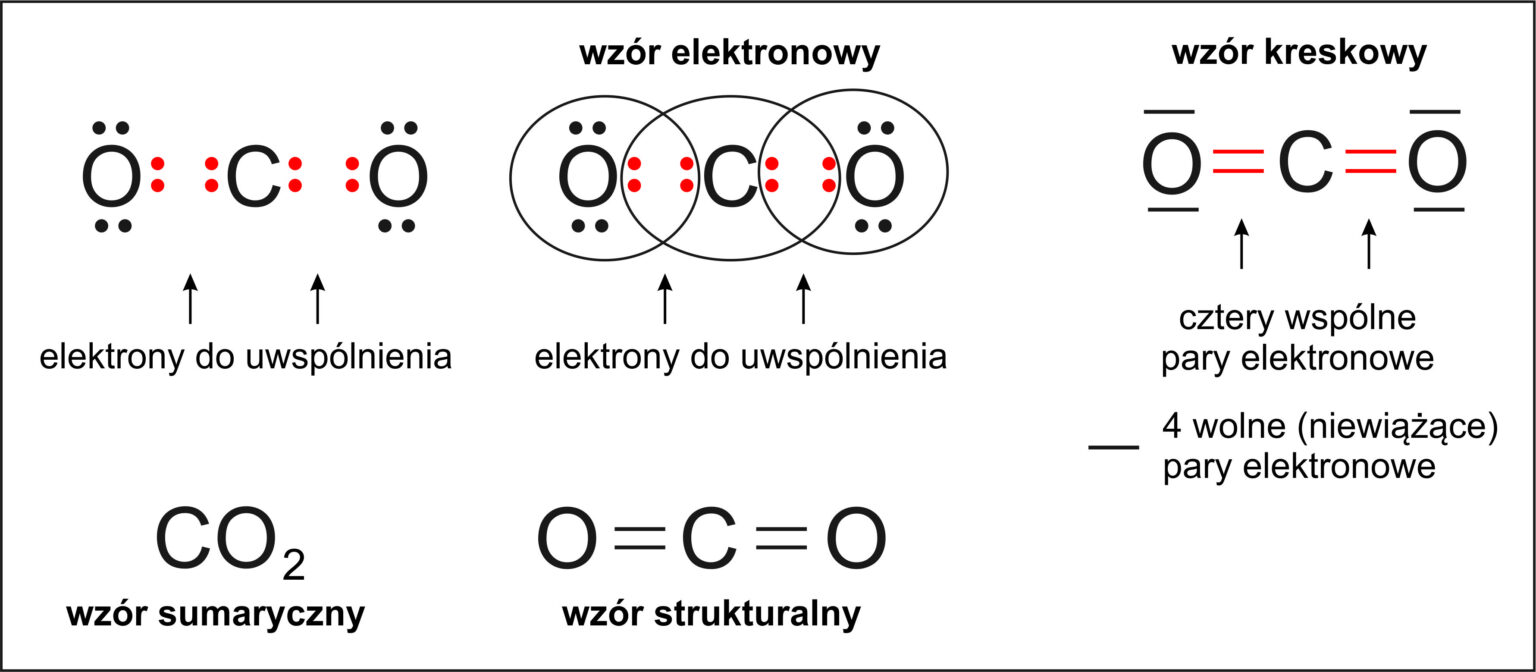
Wiązanie kowalencyjne: Powstaje, gdy atomy współdzielą elektrony. Robią to, żeby każdy z nich mógł osiągnąć oktet (lub duet). Mamy dwa rodzaje wiązań kowalencyjnych:
- Wiązanie kowalencyjne niespolaryzowane: Elektrony są równomiernie współdzielone między atomami. Dzieje się tak, gdy łączą się atomy tego samego pierwiastka, np. w cząsteczce wodoru (H2) czy tlenu (O2).
- Wiązanie kowalencyjne spolaryzowane: Elektrony są przesunięte w stronę atomu o większej elektroujemności (zdolności do przyciągania elektronów). Powoduje to powstanie cząstkowego ładunku ujemnego (δ-) na atomie o większej elektroujemności i cząstkowego ładunku dodatniego (δ+) na atomie o mniejszej elektroujemności. Przykładem jest woda (H2O), gdzie tlen jest bardziej elektroujemny niż wodór.
-
Wiązanie metaliczne: Występuje w metalach. Atomy metalu oddają swoje elektrony walencyjne, tworząc „morze” elektronów, w którym zanurzone są jony dodatnie metalu. Te swobodne elektrony są odpowiedzialne za dobre przewodnictwo elektryczne i cieplne metali, a także za ich kowalność i ciągliwość.
Zapis Równań Reakcji Chemicznych
Równanie reakcji chemicznej to zapis, który informuje nas o tym, jakie substancje (reaktanty) reagują ze sobą i jakie substancje (produkty) powstają w wyniku reakcji. Równanie musi być zgodne z prawem zachowania masy, co oznacza, że liczba atomów każdego pierwiastka po stronie reaktantów musi być równa liczbie atomów tego pierwiastka po stronie produktów.
Kroki do poprawnego zapisu równania reakcji:
- Zapisz wzory chemiczne reaktantów i produktów. Pamiętaj o prawidłowych wzorach sumarycznych (np. H2O, CO2) i strukturalnych (pokazujących, jak atomy są połączone).
- Ustal współczynniki stechiometryczne. Są to liczby, które stawiamy przed wzorami chemicznymi, aby zrównoważyć równanie. Robimy to, dobierając takie liczby, aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania.
- Sprawdź, czy równanie jest zrównoważone. Upewnij się, że liczba atomów każdego pierwiastka jest taka sama po stronie reaktantów i produktów.
Przykład: Spalanie metanu (CH4) w tlenie (O2)
CH4 + O2 → CO2 + H2O (nierównoważone)
Żeby zrównoważyć to równanie, musimy dodać współczynniki:
CH4 + 2O2 → CO2 + 2H2O (zrównoważone)
Teraz mamy: 1 atom węgla, 4 atomy wodoru i 4 atomy tlenu po obu stronach równania.
Typy Reakcji Chemicznych
Warto znać kilka podstawowych typów reakcji chemicznych:
-
Reakcja syntezy (łączenia): Dwie lub więcej substancji łączą się, tworząc jedną substancję. Przykład: N2 + 3H2 → 2NH3 (synteza amoniaku)
-
Reakcja analizy (rozkładu): Jedna substancja rozkłada się na dwie lub więcej substancji. Przykład: 2H2O → 2H2 + O2 (elektroliza wody)
-
Reakcja wymiany: Atom lub grupa atomów w jednej substancji jest zastępowana przez atom lub grupę atomów w innej substancji. Mamy dwa rodzaje reakcji wymiany:
- Reakcja wymiany pojedynczej: Jeden pierwiastek wypiera inny pierwiastek ze związku chemicznego. Przykład: Zn + CuSO4 → ZnSO4 + Cu (cynk wypiera miedź z siarczanu miedzi(II))
- Reakcja wymiany podwójnej: Dwie substancje wymieniają się swoimi jonami. Często prowadzi to do powstania osadu, gazu lub wody. Przykład: AgNO3 + NaCl → AgCl↓ + NaNO3 (powstaje osad chlorku srebra)
Elektroujemność i Polarność Wiązań
Elektroujemność, o której wspominałem wcześniej, to bardzo ważna właściwość pierwiastków. Określa ona zdolność atomu do przyciągania elektronów w wiązaniu chemicznym. Im większa różnica elektroujemności między atomami, tym bardziej polarne jest wiązanie.
Zapamiętajcie:
- Różnica elektroujemności bliska zeru: wiązanie kowalencyjne niespolaryzowane.
- Różnica elektroujemności umiarkowana (np. 0.4 - 1.7): wiązanie kowalencyjne spolaryzowane.
- Różnica elektroujemności duża (powyżej 1.7): wiązanie jonowe.
Znając elektroujemność pierwiastków, możemy przewidzieć, jaki rodzaj wiązania powstanie między nimi. Informacje o elektroujemności znajdziecie w układzie okresowym pierwiastków (zazwyczaj podane są wartości elektroujemności w skali Paulinga).
Przykłady Reakcji i Równań
Przejdźmy teraz do kilku przykładów, które pomogą wam utrwalić wiedzę:
-
Reakcja spalania węgla: C + O2 → CO2 (węgiel reaguje z tlenem, tworząc dwutlenek węgla)
-
Reakcja syntezy wody: 2H2 + O2 → 2H2O (wodór reaguje z tlenem, tworząc wodę)
-
Reakcja rozkładu tlenku rtęci(II): 2HgO → 2Hg + O2 (tlenek rtęci(II) rozkłada się na rtęć i tlen)
-
Reakcja kwasu solnego z zasadą sodową (neutralizacja): HCl + NaOH → NaCl + H2O (kwas solny reaguje z zasadą sodową, tworząc chlorek sodu i wodę)
Dodatkowe Wskazówki
- Ćwiczcie pisanie równań reakcji. Im więcej równań napiszecie i zrównoważycie, tym lepiej to opanujecie.
- Zwracajcie uwagę na stany skupienia substancji (s – stały, l – ciekły, g – gazowy, aq – roztwór wodny). Czasami trzeba je dopisać do równania.
- Uczcie się na pamięć popularnych wzorów i nazw związków chemicznych. Ułatwi to wam rozwiązywanie zadań.
- Rozwiązujcie zadania z podręcznika i zbiorów zadań. To najlepszy sposób na sprawdzenie swojej wiedzy.
Mam nadzieję, że to obszerne omówienie pomoże wam przygotować się do sprawdzianu z chemii. Pamiętajcie, że chemia to przede wszystkim praktyka. Im więcej będziecie ćwiczyć, tym lepiej zrozumiecie te zagadnienia. Powodzenia!