Sprawdzian Chemia Klasa 7 Dział 1

Chemia to fascynująca nauka, która bada skład, strukturę, właściwości i reakcje materii. Dla uczniów klasy 7, Dział 1 podręcznika do chemii stanowi fundament dalszej nauki. Ten dział wprowadza podstawowe pojęcia, które są niezbędne do zrozumienia bardziej zaawansowanych zagadnień chemicznych. Przygotowanie do sprawdzianu z tego działu wymaga zrozumienia kluczowych definicji, praw i zasad. Niniejszy artykuł ma na celu pomóc uczniom w efektywnym przygotowaniu do sprawdzianu z chemii, klasa 7, dział 1, poprzez omówienie najważniejszych zagadnień, dostarczenie przykładów i wskazówek.
Podstawowe pojęcia chemiczne
Substancje i ciała
Substancja to rodzaj materii o określonych właściwościach chemicznych i fizycznych. Może to być pierwiastek, związek chemiczny lub mieszanina. Ciało z kolei to obiekt zbudowany z jednej lub więcej substancji. Przykładowo, żelazny gwóźdź (ciało) zbudowany jest z żelaza (substancja). Ważne jest, aby rozumieć różnicę między tymi pojęciami, ponieważ często są one mylone.
Przykłady:
- Substancje: woda (H2O), tlen (O2), sól kuchenna (NaCl)
- Ciała: szklanka (zbudowana ze szkła), stół (zbudowany z drewna), moneta (zbudowana z metalu)
Właściwości substancji
Substancje charakteryzują się różnymi właściwościami, które można podzielić na fizyczne i chemiczne. Właściwości fizyczne opisują, jak substancja wygląda i jak reaguje na bodźce fizyczne, np. temperaturę, ciśnienie, światło. Do właściwości fizycznych zaliczamy: stan skupienia (stały, ciekły, gazowy), barwę, zapach, gęstość, temperaturę wrzenia i topnienia, rozpuszczalność w wodzie.
Właściwości chemiczne opisują, jak substancja reaguje z innymi substancjami. Mówią one o zdolności substancji do wchodzenia w reakcje chemiczne, np. palność, kwasowość, zasadowość, reaktywność z innymi pierwiastkami i związkami. Zrozumienie różnicy między właściwościami fizycznymi i chemicznymi jest kluczowe dla identyfikacji i charakterystyki substancji.
Przykłady:
- Właściwości fizyczne wody: bezbarwna, bezwonna, temperatura wrzenia 100°C, temperatura topnienia 0°C, gęstość 1 g/cm3.
- Właściwości chemiczne żelaza: rdzewieje w obecności tlenu i wody (reakcja z tlenem), reaguje z kwasami.
Pierwiastki i związki chemiczne
Pierwiastek to substancja prosta, której nie można rozłożyć na prostsze substancje za pomocą metod chemicznych. Składa się z atomów jednego rodzaju. Przykłady: tlen (O), węgiel (C), żelazo (Fe), złoto (Au). Związek chemiczny to substancja, która składa się z dwóch lub więcej pierwiastków połączonych ze sobą trwale w określonych proporcjach. Przykłady: woda (H2O), dwutlenek węgla (CO2), chlorek sodu (NaCl).
Kluczowe jest, aby zrozumieć, że związek chemiczny ma zupełnie inne właściwości niż pierwiastki, z których się składa. Na przykład, wodór (H2) i tlen (O2) to gazy, które są wybuchowe, natomiast woda (H2O), która powstaje z ich połączenia, gasi ogień.
Mieszaniny
Mieszanina to połączenie dwóch lub więcej substancji, które nie weszły w reakcję chemiczną i zachowują swoje właściwości. Mieszaniny można podzielić na jednorodne i niejednorodne. Mieszaniny jednorodne (roztwory) mają jednolity skład w całej objętości, np. roztwór soli w wodzie, powietrze. Mieszaniny niejednorodne mają widoczne składniki, które można odróżnić gołym okiem lub pod mikroskopem, np. piasek z wodą, zupa pomidorowa.
Metody rozdzielania mieszanin:
- Dekantacja: oddzielanie cieczy od osadu.
- Filtracja: oddzielanie ciała stałego od cieczy za pomocą filtra.
- Odparowywanie: oddzielanie substancji stałej rozpuszczonej w cieczy poprzez odparowanie cieczy.
- Destylacja: oddzielanie cieczy o różnych temperaturach wrzenia.
- Chromatografia: rozdzielanie substancji na podstawie ich różnej zdolności do przylegania do fazy stacjonarnej.
Stany skupienia materii
Materia może występować w trzech podstawowych stanach skupienia: stałym, ciekłym i gazowym. Każdy stan skupienia charakteryzuje się inną strukturą i właściwościami. W stanie stałym cząsteczki są ściśle upakowane i mają określone położenie, co nadaje ciału stały kształt i objętość. W stanie ciekłym cząsteczki są bliżej siebie niż w gazie, ale mogą się przemieszczać, co powoduje, że ciecz ma określoną objętość, ale nie ma określonego kształtu. W stanie gazowym cząsteczki są bardzo oddalone od siebie i poruszają się chaotycznie, co sprawia, że gaz nie ma ani określonego kształtu, ani objętości.
Przemiany fazowe:
- Topnienie: przejście ze stanu stałego w stan ciekły (np. lód w wodę).
- Krzepnięcie: przejście ze stanu ciekłego w stan stały (np. woda w lód).
- Parowanie: przejście ze stanu ciekłego w stan gazowy (np. woda w parę wodną).
- Skraplanie: przejście ze stanu gazowego w stan ciekły (np. para wodna w wodę).
- Sublimacja: przejście ze stanu stałego w stan gazowy (np. suchy lód w gazowy dwutlenek węgla).
- Resublimacja: przejście ze stanu gazowego w stan stały (np. para jodu w kryształy jodu).
Zrozumienie przemian fazowych jest istotne, ponieważ tłumaczy wiele zjawisk zachodzących w przyrodzie i w życiu codziennym, np. powstawanie chmur, topnienie śniegu, gotowanie wody.
Budowa atomu
Atom to podstawowy składnik materii. Składa się z jądra atomowego, które zawiera protony (cząstki o ładunku dodatnim) i neutrony (cząstki obojętne), oraz z elektronów (cząstki o ładunku ujemnym), które krążą wokół jądra na określonych orbitach. Liczba protonów w jądrze atomowym decyduje o tym, jakim pierwiastkiem jest dany atom. Liczba elektronów w atomie neutralnym jest równa liczbie protonów.
Liczba atomowa (Z) to liczba protonów w jądrze atomowym. Określa ona, który to pierwiastek. Liczba masowa (A) to suma liczby protonów i neutronów w jądrze atomowym.
Izotopy to atomy tego samego pierwiastka (mające taką samą liczbę protonów), ale różniące się liczbą neutronów w jądrze. Na przykład, węgiel występuje w postaci izotopów węgla-12 (12C) i węgla-14 (14C). Mają one odpowiednio 6 i 8 neutronów.
Zrozumienie budowy atomu jest fundamentalne dla zrozumienia właściwości pierwiastków i związków chemicznych.
Prawo stałości składu
Prawo stałości składu, sformułowane przez Josepha Prousta, mówi, że każdy związek chemiczny ma zawsze ten sam skład jakościowy (czyli te same pierwiastki) i ilościowy (czyli te same proporcje masowe pierwiastków), niezależnie od sposobu jego otrzymywania. Na przykład, woda (H2O) zawsze składa się z dwóch atomów wodoru i jednego atomu tlenu, a stosunek masowy wodoru do tlenu wynosi zawsze około 1:8.
To prawo jest podstawą chemii i pozwala na przewidywanie właściwości związków chemicznych na podstawie ich składu.
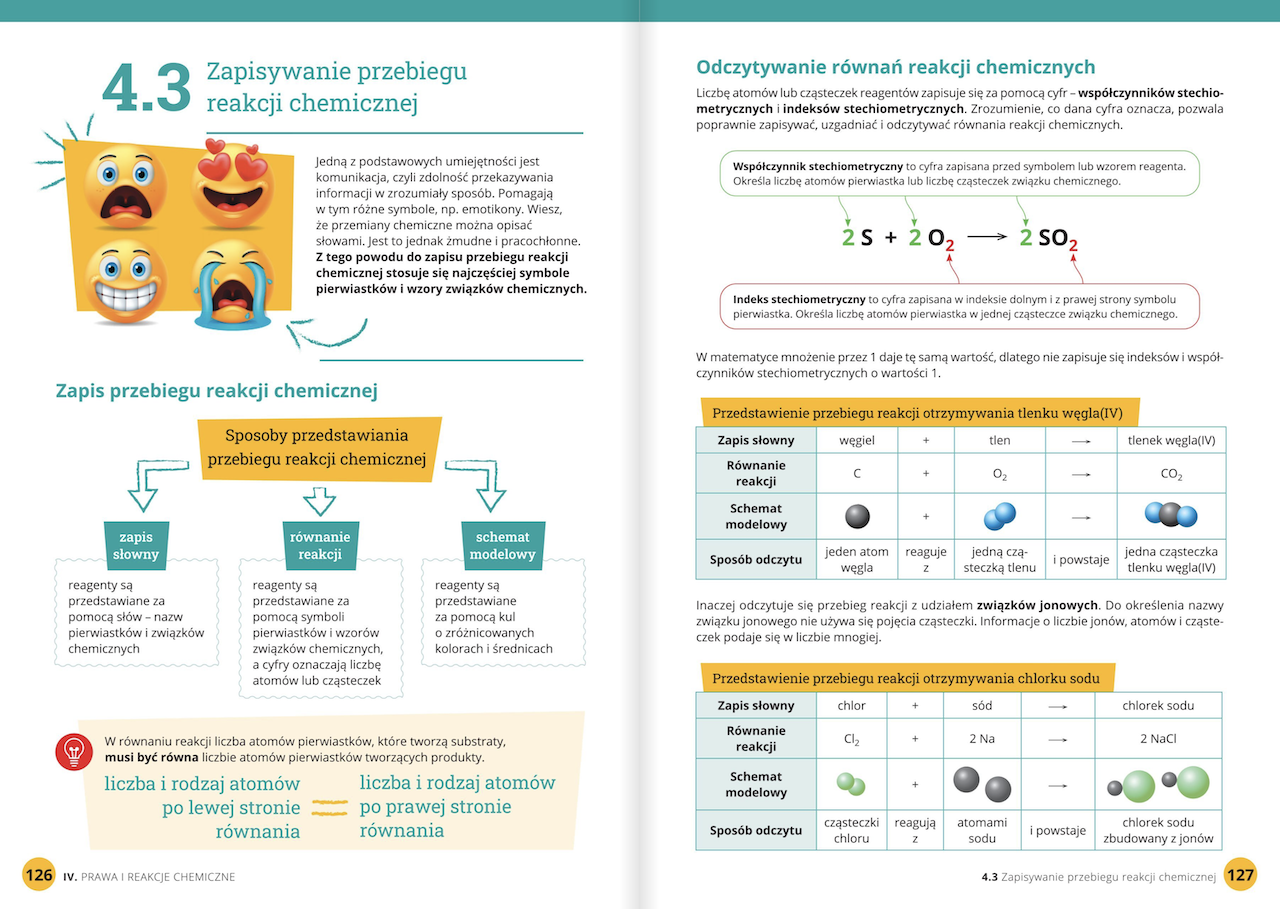
Reakcje chemiczne
Reakcja chemiczna to proces, w którym jedne substancje (reagenty) przekształcają się w inne substancje (produkty). Reakcje chemiczne zachodzą z wymianą energii. Mogą być egzotermiczne (wydzielają ciepło) lub endotermiczne (pobierają ciepło). Równanie reakcji chemicznej opisuje, jakie substancje reagują i jakie produkty powstają.
Przykłady:
- Spalanie węgla: C + O2 → CO2 (reakcja egzotermiczna)
- Rozkład węglanu wapnia: CaCO3 → CaO + CO2 (reakcja endotermiczna)
Ważne jest, aby umieć rozpoznawać reakcje chemiczne po charakterystycznych objawach, takich jak zmiana barwy, wydzielanie gazu, powstawanie osadu, wydzielanie lub pochłanianie ciepła.
Bezpieczeństwo w laboratorium chemicznym
Praca w laboratorium chemicznym wymaga przestrzegania zasad bezpieczeństwa. Należy zawsze nosić okulary ochronne i fartuch laboratoryjny. Nie wolno spożywać jedzenia ani pić w laboratorium. Należy dokładnie czytać etykiety na odczynnikach chemicznych i stosować się do instrukcji. W przypadku rozlania odczynnika należy natychmiast poinformować nauczyciela. Należy wiedzieć, gdzie znajdują się gaśnice i apteczka pierwszej pomocy.
Piktogramy ostrzegawcze: znajomość piktogramów ostrzegawczych (np. substancja żrąca, substancja toksyczna, substancja łatwopalna) jest niezbędna do bezpiecznej pracy z chemikaliami.
Podsumowanie i przygotowanie do sprawdzianu
Dział 1 chemii w klasie 7 wprowadza podstawowe pojęcia, które są kluczowe dla dalszej nauki. Zrozumienie różnicy między substancjami i ciałami, właściwości fizycznych i chemicznych, pierwiastkami i związkami chemicznymi, mieszaninami, stanami skupienia materii, budową atomu, prawem stałości składu i reakcjami chemicznymi jest niezbędne do pomyślnego zdania sprawdzianu.
Wskazówki do nauki:
- Przeczytaj uważnie podręcznik i upewnij się, że rozumiesz wszystkie definicje i pojęcia.
- Wykonuj zadania i ćwiczenia zawarte w podręczniku i zeszycie ćwiczeń.
- Powtórz najważniejsze wzory i prawa chemiczne.
- Spróbuj rozwiązać przykładowe sprawdziany lub testy dostępne online.
- Zadawaj pytania nauczycielowi, jeśli masz jakieś wątpliwości.
- Ucz się regularnie, a nie tylko na dzień przed sprawdzianem.
Pamiętaj, że chemia to nauka eksperymentalna. Staraj się obserwować reakcje chemiczne w życiu codziennym, np. podczas gotowania, pieczenia, czy sprzątania. To pomoże Ci lepiej zrozumieć i zapamiętać omawiane zagadnienia. Powodzenia na sprawdzianie!

![Sprawdzian Chemia Klasa 7 Dział 1 SPRAWDZIAN Chemia. Klasa 7: Tlenki i wodorotlenki [5] - YouTube](https://i.ytimg.com/vi/lB-CSds7Eik/maxresdefault.jpg?sqp=-oaymwEmCIAKENAF8quKqQMa8AEB-AH-CYAC0AWKAgwIABABGGUgZShlMA8=&rs=AOn4CLBHWE0z9H8yRycaPTPRqUIQ2BXF2A)