Sprawdzian Budowa Atomu A Układ Okresowy Pierwiastków Chemicznych Wsip
Hej! Czujesz się zagubiony w świecie atomów i tablicy Mendelejewa? Bez obaw! Ten artykuł jest dla Ciebie. Spróbujemy rozłożyć budowę atomu i układ okresowy na czynniki pierwsze, używając prostych wyjaśnień i wizualnych analogii. Skupimy się na tym, żeby zrozumieć, a nie tylko wkuć na pamięć. Pomyśl o tym jak o mapie, która pomoże Ci odnaleźć się w chemicznym wszechświecie.
Budowa Atomu: Fundament Wszelkiej Materii
Wyobraź sobie, że atom to małe Słońce, wokół którego krążą maleńkie planety. Oczywiście, to uproszczenie, ale pomoże Ci to wizualizować. W samym centrum atomu znajduje się jądro, które składa się z dwóch rodzajów cząstek:
- Protony: Mają ładunek dodatni (+) i definiują, czym dany atom jest. Czyli liczba protonów decyduje, czy masz do czynienia z atomem wodoru, węgla czy złota. Pomyśl o liczbie protonów jak o numerze PESEL atomu – jest unikalny i niezmienny.
- Neutrony: Nie mają ładunku (są neutralne). Działają jak klej, który utrzymuje protony w jądrze, zapobiegając ich odpychaniu się. Atom może mieć różną liczbę neutronów, co prowadzi do powstania izotopów – o tym później.
Wokół jądra krążą elektrony. Mają ładunek ujemny (-) i są znacznie lżejsze od protonów i neutronów. Krążą one po konkretnych ścieżkach, nazywanych orbitalami lub powłokami elektronowymi. Wyobraź sobie te powłoki jako kolejne okręgi wokół jądra – im dalej od jądra, tym wyższa energia elektronów na tej powłoce. Pierwsza powłoka może pomieścić maksymalnie 2 elektrony, druga – 8, a trzecia – 18 (chociaż ta reguła ma wyjątki!).
Ważne: Atom w stanie neutralnym ma tyle samo protonów i elektronów. Dzięki temu ładunki dodatnie i ujemne się równoważą.
Liczba Atomowa i Liczba Masowa
Żeby opisać atom, używamy dwóch ważnych liczb:
- Liczba atomowa (Z): To liczba protonów w jądrze atomu. Jak już wspominaliśmy, definiuje ona, jaki to pierwiastek. W układzie okresowym pierwiastki są ułożone w kolejności rosnącej liczby atomowej.
- Liczba masowa (A): To suma protonów i neutronów w jądrze atomu. Różne izotopy danego pierwiastka mają różne liczby masowe, bo mają różną liczbę neutronów.
Przykład: Atom węgla ma liczbę atomową 6 (czyli 6 protonów) i zazwyczaj liczbę masową 12 (6 protonów + 6 neutronów). Ale istnieje też izotop węgla o liczbie masowej 14 (6 protonów + 8 neutronów) – to węgiel-14, używany do datowania znalezisk archeologicznych!
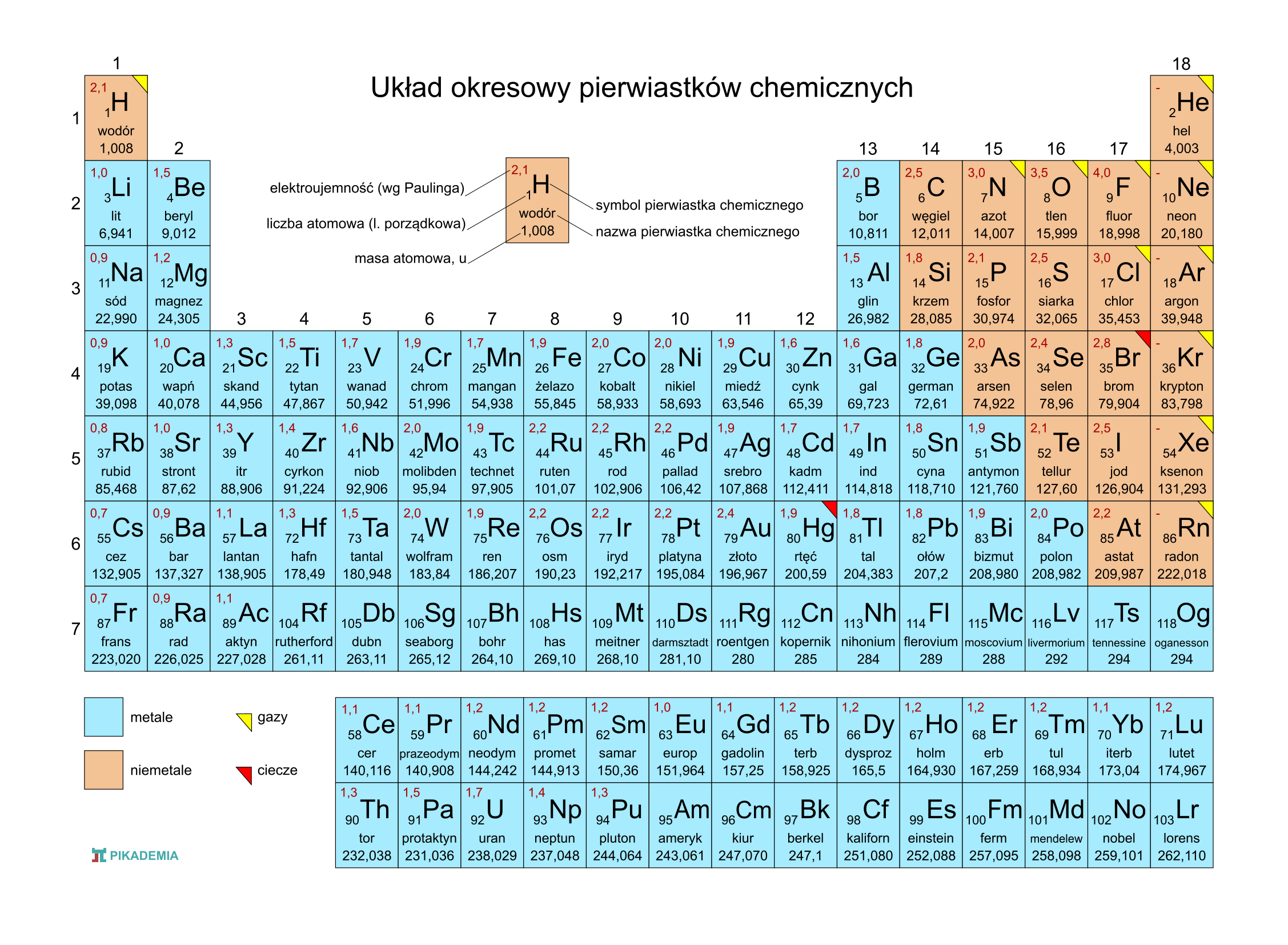
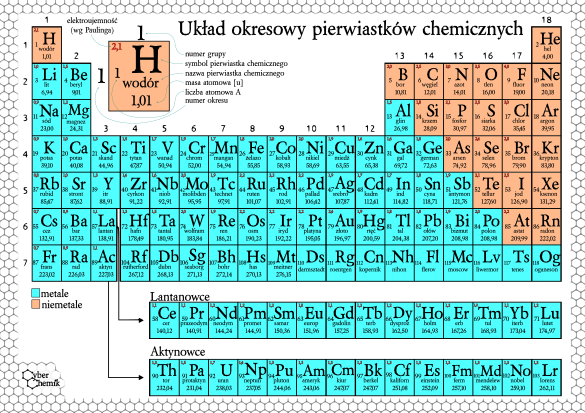
Układ Okresowy Pierwiastków Chemicznych: Mapa Chemicznego Świata
Układ okresowy to tabela, w której wszystkie znane pierwiastki są ułożone w uporządkowany sposób. To jak biblioteka, w której każdy pierwiastek ma swoje miejsce, a jego położenie zdradza wiele o jego właściwościach.
Układ okresowy jest podzielony na:
- Grupy (kolumny): Pierwiastki w tej samej grupie mają podobne właściwości chemiczne, ponieważ mają taką samą liczbę elektronów na ostatniej powłoce (elektrony walencyjne). To te elektrony są odpowiedzialne za reakcje chemiczne! Na przykład, pierwiastki z grupy 1 (metale alkaliczne) są bardzo reaktywne i łatwo tworzą związki chemiczne.
- Okresy (rzędy): Pierwiastki w tym samym okresie mają elektrony na tej samej liczbie powłok elektronowych. Wraz ze wzrostem liczby atomowej w okresie zmieniają się właściwości pierwiastków – od metali, przez półmetale, do niemetali.
Jak czytać układ okresowy?
Zazwyczaj w każdym polu w układzie okresowym znajdziesz następujące informacje:
- Symbol pierwiastka: Skrótowa nazwa, np. H dla wodoru, O dla tlenu, Fe dla żelaza.
- Liczba atomowa (Z): Jak już wiesz, liczba protonów.
- Masa atomowa: Średnia masa atomu, uwzględniająca naturalne występowanie izotopów danego pierwiastka.
Trendy w Układzie Okresowym
W układzie okresowym obserwujemy pewne trendy, czyli systematyczne zmiany we właściwościach pierwiastków. Kilka przykładów:
- Elektroujemność: Zdolność atomu do przyciągania elektronów w wiązaniu chemicznym. Elektroujemność rośnie w prawo w okresie i w górę w grupie. Fluor (F) jest najbardziej elektroujemnym pierwiastkiem.
- Energia jonizacji: Energia potrzebna do oderwania elektronu od atomu. Energia jonizacji rośnie w prawo w okresie i w górę w grupie.
- Promień atomowy: Rozmiar atomu. Promień atomowy maleje w prawo w okresie i rośnie w dół w grupie.
Zapamiętaj: Układ okresowy to nie tylko zbiór pierwiastków. To skarbnica wiedzy o ich właściwościach i zachowaniu. Im lepiej go zrozumiesz, tym łatwiej będzie Ci poruszać się po świecie chemii.
Praktyczne Zastosowanie Układu Okresowego
Układ okresowy jest niezwykle przydatny w wielu dziedzinach nauki i technologii. Na przykład:
- Projektowanie leków: Znając właściwości różnych pierwiastków, naukowcy mogą projektować leki, które oddziałują z konkretnymi receptorami w organizmie.
- Synteza nowych materiałów: Układ okresowy pomaga przewidywać, jakie związki mogą powstać i jakie będą miały właściwości.
- Analiza środowiska: Możemy określić zawartość różnych pierwiastków w próbkach wody, gleby czy powietrza, co pozwala na ocenę stanu środowiska.
Podsumowując, zrozumienie budowy atomu i układu okresowego jest kluczowe dla każdego, kto chce zgłębić tajniki chemii. Mamy nadzieję, że ten artykuł pomógł Ci uporządkować wiedzę i poczuć się pewniej w tym fascynującym świecie. Pamiętaj, że nauka to proces, a regularne powtarzanie i rozwiązywanie zadań to klucz do sukcesu! Powodzenia!