Sposoby Otrzymywania Wodorotlenków
Witaj! Zapewne zastanawiasz się, jak w ogóle powstają te wodorotlenki, które widzimy w laboratoriach, w lekach, a nawet w domowych środkach czystości. Nie martw się, nie jesteś sam! Chemia potrafi być skomplikowana, ale postaram się to wytłumaczyć w prosty i przystępny sposób. Wiele osób uważa chemię za coś odległego i niezwiązanego z ich życiem, ale wodorotlenki są wszędzie! Od neutralizacji kwasów w żołądku po produkcję papieru – ich obecność jest nieoceniona.
Wodorotlenki – co to takiego?
Zanim przejdziemy do sposobów ich otrzymywania, warto przypomnieć sobie, czym właściwie są wodorotlenki. Najprościej mówiąc, to związki chemiczne, które zawierają grupę wodorotlenową (OH⁻) związaną z metalem lub grupą organiczną. To właśnie ta grupa OH⁻ nadaje im charakterystyczne właściwości, w tym zdolność do reagowania z kwasami.
Ważne jest rozróżnienie na wodorotlenki metali i te organiczne, nazywane często alkoholami lub fenolami. Chociaż obie grupy zawierają OH⁻, ich właściwości i sposoby otrzymywania są różne. My skupimy się głównie na wodorotlenkach metali, ze względu na ich szerokie zastosowanie w przemyśle i życiu codziennym.
Sposoby otrzymywania wodorotlenków metali
Istnieje kilka głównych metod otrzymywania wodorotlenków metali. Każda z nich ma swoje zalety i ograniczenia, a wybór konkretnej metody zależy od rodzaju metalu, skali produkcji i dostępnych zasobów. Przyjrzyjmy się im bliżej:
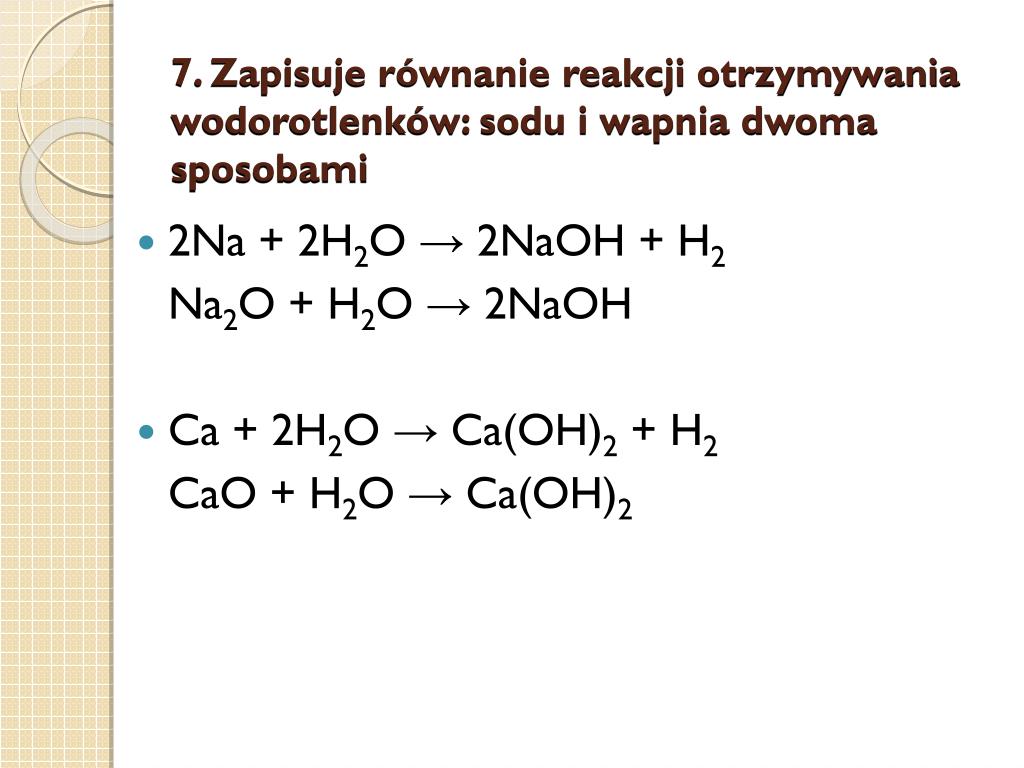
1. Reakcja metalu z wodą
Najprostsza i najbardziej intuicyjna metoda to reakcja metalu z wodą. Jednak nie wszystkie metale reagują z wodą w ten sposób. Metale alkaliczne (lit, sód, potas, rubid, cez, frans) i metale ziem alkalicznych (wapń, stront, bar) reagują z wodą burzliwie, tworząc wodorotlenek i wodór:
2Na + 2H₂O → 2NaOH + H₂
Ca + 2H₂O → Ca(OH)₂ + H₂
Ważne: Reakcja z metalami alkalicznymi jest bardzo egzotermiczna i może prowadzić do zapłonu wodoru! Należy zachować szczególną ostrożność i stosować odpowiednie środki bezpieczeństwa.
Dlaczego tylko te metale reagują z wodą w ten sposób? To zależy od ich potencjału standardowego – im bardziej ujemny potencjał, tym silniej metal dąży do oddania elektronów i tym łatwiej reaguje z wodą.
2. Reakcja tlenku metalu z wodą
Innym sposobem jest reakcja tlenku metalu z wodą. Metoda ta jest szczególnie przydatna do otrzymywania wodorotlenków metali alkalicznych i ziem alkalicznych:
Na₂O + H₂O → 2NaOH
CaO + H₂O → Ca(OH)₂
Tlenek wapnia (CaO), zwany również wapnem palonym, reaguje z wodą bardzo intensywnie, wydzielając dużo ciepła. Produktem tej reakcji jest wapno gaszone (Ca(OH)₂), wykorzystywane w budownictwie.
Tlenki metali mniej reaktywnych, takie jak tlenki żelaza czy miedzi, nie reagują z wodą w taki sposób.
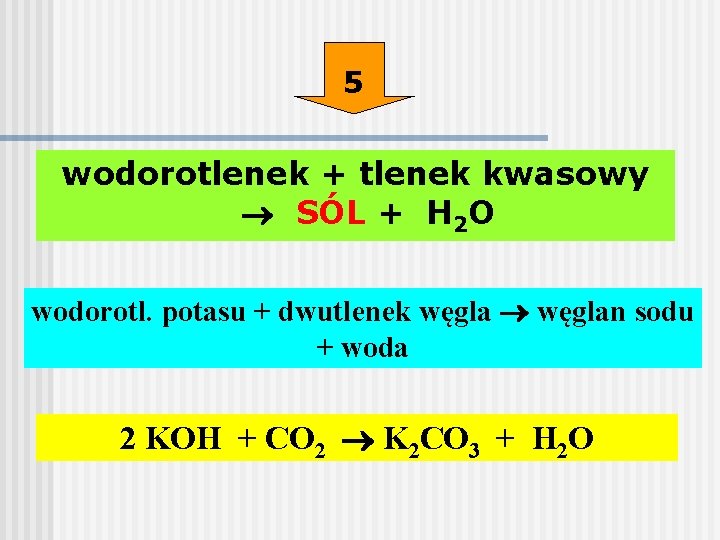
3. Reakcja soli metalu z zasadą
Bardziej uniwersalną metodą jest reakcja soli metalu z zasadą. W tej reakcji powstaje wodorotlenek metalu i nowa sól. Reakcja ta zachodzi, gdy powstający wodorotlenek jest nierozpuszczalny w wodzie (tworzy się osad):
CuSO₄ + 2NaOH → Cu(OH)₂↓ + Na₂SO₄
FeCl₃ + 3NaOH → Fe(OH)₃↓ + 3NaCl
Symbol "↓" oznacza, że substancja wytrąca się z roztworu w postaci osadu.
Przykład z życia codziennego: W oczyszczalniach ścieków często stosuje się reakcję chlorku żelaza(III) z wodorotlenkiem wapnia w celu usunięcia fosforanów z wody. Powstający wodorotlenek żelaza(III) wiąże fosforany, tworząc nierozpuszczalny osad, który jest następnie usuwany.
4. Elektroliza roztworów soli
Elektroliza roztworów soli jest metodą bardziej zaawansowaną i stosowaną głównie w przemyśle. Polega na przepuszczaniu prądu elektrycznego przez roztwór soli. W wyniku elektrolizy na elektrodach zachodzą reakcje utleniania i redukcji, prowadzące do powstania wodorotlenku, gazu (np. chloru) i wodoru.
Przykład: Elektroliza roztworu chlorku sodu (solanki) prowadzi do otrzymania wodorotlenku sodu (NaOH), chloru (Cl₂) i wodoru (H₂). Jest to metoda przemysłowa produkcji wodorotlenku sodu, znanego również jako soda kaustyczna.
2NaCl + 2H₂O → 2NaOH + Cl₂ + H₂
Produkty elektrolizy – wodorotlenek sodu i chlor – są wykorzystywane w wielu gałęziach przemysłu, m.in. w produkcji papieru, tworzyw sztucznych, detergentów i środków dezynfekujących.
Przeciwwskazania i alternatywne metody
Oczywiście, nie każda z wymienionych metod jest idealna w każdej sytuacji. Niektóre metale reagują z wodą zbyt gwałtownie, inne wcale. Reakcja soli z zasadą wymaga użycia rozpuszczalnych soli i odpowiedniej zasady, a elektroliza jest procesem energochłonnym. Dodatkowo, niektóre reakcje mogą generować niebezpieczne produkty uboczne, takie jak wodór, który jest łatwopalny.
Alternatywne metody, chociaż rzadziej stosowane, obejmują:
- Redukcję tlenków metali w obecności pary wodnej: Metoda ta polega na przepuszczaniu pary wodnej przez ogrzany tlenek metalu w obecności reduktora.
- Reakcję metali z alkoholem w obecności wody: Ta metoda jest stosowana do otrzymywania wodorotlenków metali, które reagują z wodą zbyt gwałtownie.
Wpływ na nasze życie
Wodorotlenki, jak już wspomniałem, mają ogromny wpływ na nasze życie. Wodorotlenek sodu (NaOH), znany jako soda kaustyczna, jest używany do produkcji papieru, mydła, detergentów, a także do udrażniania rur. Wodorotlenek wapnia (Ca(OH)₂), czyli wapno gaszone, jest podstawowym składnikiem zapraw budowlanych i służy do bielenia ścian. Wodorotlenek magnezu (Mg(OH)₂) jest składnikiem leków zobojętniających kwas żołądkowy.
Pamiętajmy jednak, że wodorotlenki, zwłaszcza te silne, są substancjami żrącymi i należy obchodzić się z nimi ostrożnie, stosując odpowiednie środki ochrony osobistej.
Podsumowanie
Otrzymywanie wodorotlenków to proces, który może przebiegać na wiele sposobów, w zależności od rodzaju metalu i skali produkcji. Od prostej reakcji metalu z wodą, po bardziej zaawansowaną elektrolizę – każda metoda ma swoje zalety i ograniczenia. Mam nadzieję, że ten artykuł pomógł Ci zrozumieć podstawowe zasady otrzymywania wodorotlenków i docenić ich rolę w naszym życiu.
Wybór odpowiedniej metody zależy od wielu czynników, w tym od dostępności surowców, kosztów i względów bezpieczeństwa. Pamiętaj, że chemia to nie tylko teoria, ale przede wszystkim praktyka, która ma realny wpływ na nasze otoczenie.
Teraz, kiedy już wiesz, jak powstają wodorotlenki, zastanów się, w jakich produktach, których używasz na co dzień, one występują? Może to być doskonały początek do dalszego zgłębiania fascynującego świata chemii!