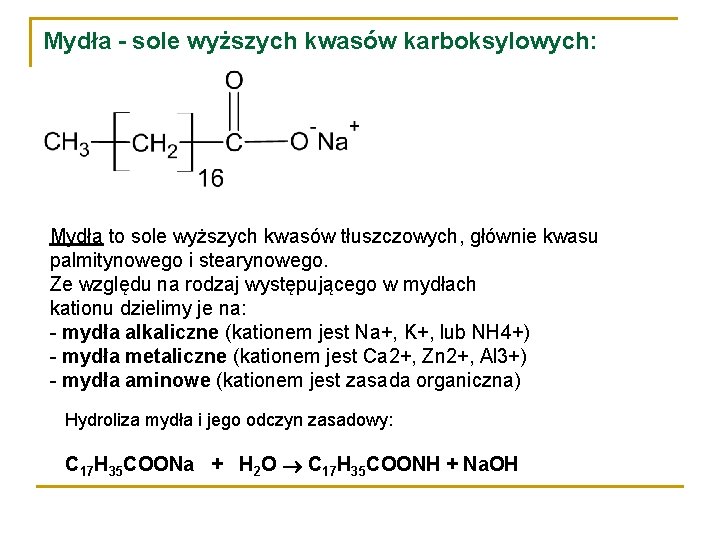
Sole Sodowe Lub Potasowe Wyższych Kwasów Karboksylowych To
Mydła. Słowo, które przywołuje na myśl czystość, świeżość i… chemię. Ale czy zastanawialiście się kiedyś, czym tak naprawdę są te substancje, które tak chętnie używamy każdego dnia? W niniejszym artykule przyjrzymy się bliżej solom sodowym lub potasowym wyższych kwasów karboksylowych, czyli właśnie mydłom, skupiając się na ich budowie, właściwościach oraz procesie powstawania.
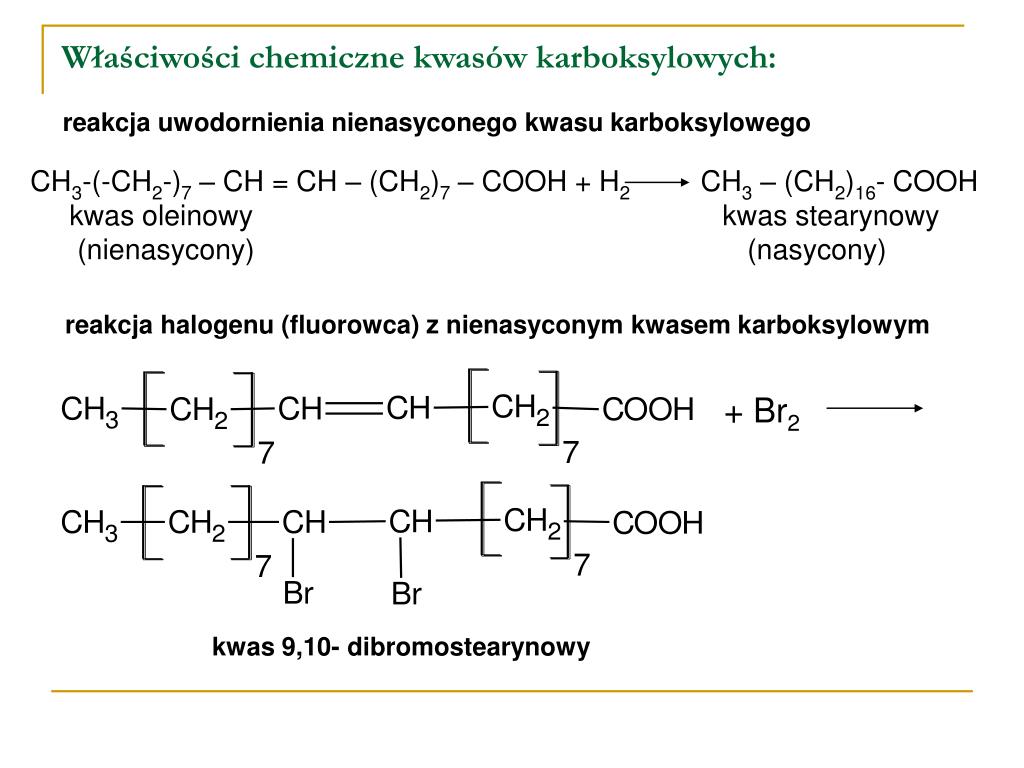
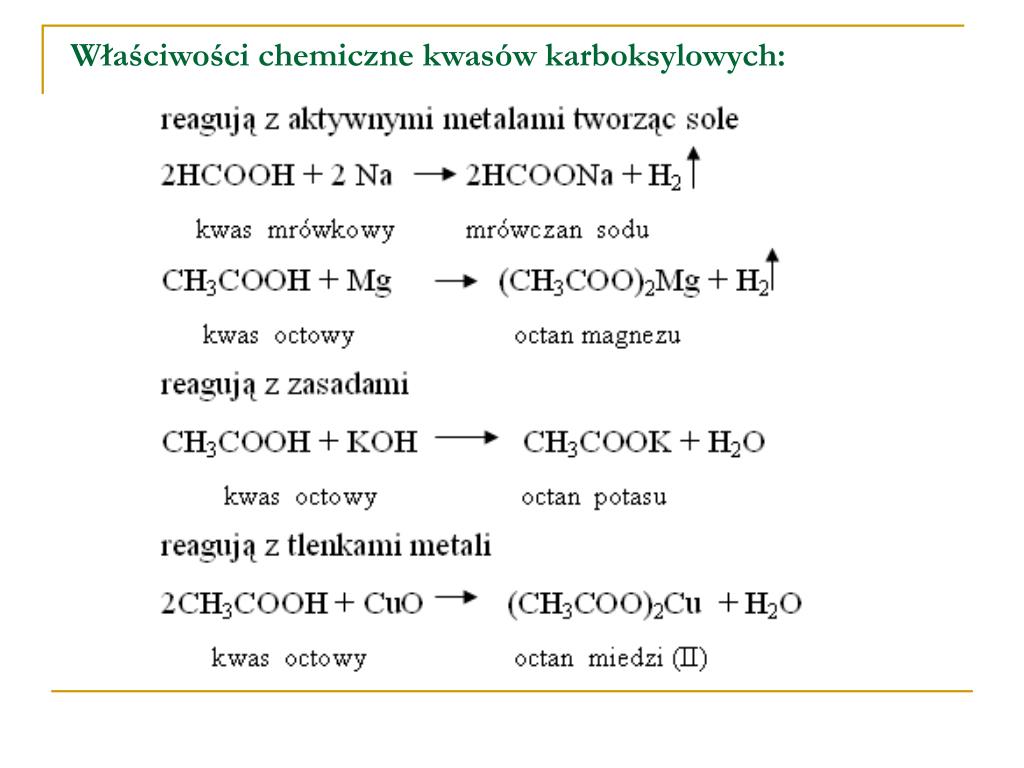
Sama nazwa "sole sodowe lub potasowe wyższych kwasów karboksylowych" brzmi dość skomplikowanie. Spróbujmy ją rozłożyć na czynniki pierwsze. Mówimy o solach. W chemii, sole to związki chemiczne powstałe w wyniku reakcji kwasu z zasadą. W naszym przypadku, kwasem są wyższe kwasy karboksylowe, a zasadą - wodorotlenek sodu (NaOH) lub wodorotlenek potasu (KOH). "Wyższe" kwasy karboksylowe to takie, które zawierają długie łańcuchy węglowodorowe. Im dłuższy łańcuch, tym lepsze właściwości myjące ma powstałe mydło. Typowe kwasy tłuszczowe wchodzące w skład mydeł to kwas palmitynowy (C16H32O2), kwas stearynowy (C18H36O2) oraz kwas oleinowy (C18H34O2).
Czyli mydło to nic innego jak sól, utworzona przez połączenie długiego kwasu tłuszczowego z sodem lub potasem. Ta specyficzna budowa nadaje mydłom ich unikalne właściwości.
Budowa Mydła – Klucz do Właściwości
Molekuła mydła charakteryzuje się amfifilową naturą. Oznacza to, że posiada dwie różne części: hydrofobową (nierozpuszczalną w wodzie) i hydrofilową (rozpuszczalną w wodzie). Część hydrofobowa to długi łańcuch węglowodorowy, który "lubi" tłuszcze i oleje, a "unika" wody. Część hydrofilowa to grupa karboksylanowa (COO-) z przyłączonym jonem sodu (Na+) lub potasu (K+), która "lubi" wodę.
Ta dwoista natura jest kluczowa dla mechanizmu działania mydła. Kiedy mydło dodawane jest do wody, molekuły mydła ustawiają się w taki sposób, aby ich hydrofobowe ogony zanurzyły się w tłuszczu (np. brudzie na skórze), a hydrofilowe głowy pozostały w wodzie. Molekuły mydła otaczają cząsteczki tłuszczu, tworząc micelle. Micelle to kuliste struktury, w których wnętrzu znajdują się cząsteczki tłuszczu otoczone przez hydrofobowe ogony mydła, a na zewnątrz znajdują się hydrofilowe głowy, skierowane w stronę wody. Dzięki temu micelle mogą być łatwo spłukane wodą, usuwając tym samym brud i tłuszcz.
To dlatego mydło jest tak skuteczne w usuwaniu brudu. Nie rozpuszcza go bezpośrednio, ale emulguje, czyli rozprasza w wodzie, tworząc drobną zawiesinę, którą można łatwo spłukać.
Proces Saponifikacji – Narodziny Mydła
Proces powstawania mydła nazywa się saponifikacją, czyli zmydlaniem. Jest to reakcja hydrolizy tłuszczów lub olejów w środowisku zasadowym. Najczęściej używa się do tego wodorotlenku sodu (NaOH) lub wodorotlenku potasu (KOH).
Reakcja saponifikacji przebiega w następujący sposób: tłuszcz (trójgliceryd) reaguje z wodorotlenkiem sodu lub potasu, w wyniku czego powstaje mydło (mieszanina soli sodowych lub potasowych wyższych kwasów karboksylowych) oraz glicerol (gliceryna).
Równanie ogólne reakcji saponifikacji (uproszczone):
Tłuszcz + Wodorotlenek Sodu/Potasu → Mydło + Glicerol
Na przykład, jeśli do zmydlania użyjemy tristearynianu glicerolu (tłuszczu) i wodorotlenku sodu, otrzymamy stearynian sodu (mydło) i glicerol.
Proces saponifikacji może być przeprowadzany na ciepło lub na zimno. Metoda na ciepło jest szybsza i bardziej efektywna, ale wymaga kontroli temperatury i może prowadzić do degradacji niektórych składników. Metoda na zimno jest wolniejsza, ale pozwala na zachowanie większej ilości naturalnych składników tłuszczów i olejów.
Po zakończeniu procesu saponifikacji mydło oddziela się od glicerolu i innych produktów ubocznych. Można to zrobić poprzez dodanie do mieszaniny roztworu soli kuchennej (NaCl). Mydło wypływa na powierzchnię w postaci skrzepu, który następnie zbiera się i przetwarza dalej.
Różnice Między Mydłem Sodowym a Potasowym
Mydła sodowe i potasowe różnią się między sobą kilkoma właściwościami. Mydła sodowe (powstałe z użyciem NaOH) są twarde i tworzą gęstą pianę. Są one powszechnie używane do produkcji mydeł w kostkach. Mydła potasowe (powstałe z użyciem KOH) są miękkie lub płynne i tworzą bardziej kremową pianę. Są one często używane do produkcji mydeł w płynie i mydeł do golenia.
Różnica w twardości wynika z różnicy w wielkości jonów sodu i potasu. Jon potasu jest większy od jonu sodu, co powoduje, że mydła potasowe mają luźniejszą strukturę i są bardziej miękkie.
Mydła potasowe są również bardziej rozpuszczalne w wodzie niż mydła sodowe. Dlatego też łatwiej jest uzyskać mydło w płynie z użyciem wodorotlenku potasu.
Dodatkowo, mydła potasowe są uważane za delikatniejsze dla skóry niż mydła sodowe. Wynika to z ich wyższej zawartości glicerolu, który jest naturalnym humektantem, czyli substancją nawilżającą skórę.
Podsumowując, wybór między mydłem sodowym a potasowym zależy od preferencji użytkownika i zamierzonego zastosowania. Mydła sodowe są bardziej ekonomiczne i tworzą gęstą pianę, podczas gdy mydła potasowe są delikatniejsze i bardziej nawilżające.
Mydła, te proste, ale niezwykle skuteczne środki czystości, towarzyszą nam od wieków. Ich działanie opiera się na genialnej prostocie, wykorzystującej amfifilową budowę molekuł i proces saponifikacji. Niezależnie od tego, czy wybieramy mydło w kostce, w płynie, sodowe czy potasowe, warto pamiętać o chemii, która za nim stoi.