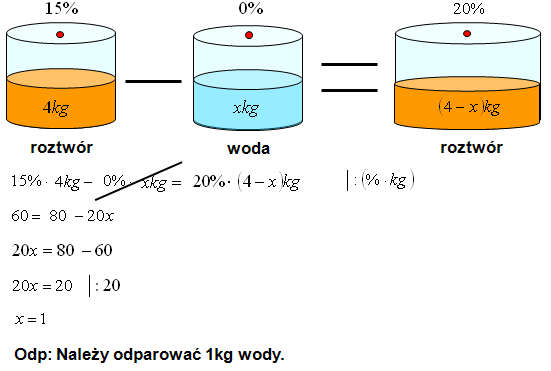
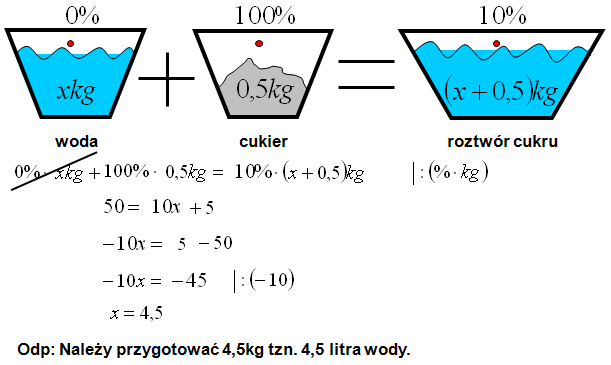
Roztwory Stężenie Procentowe

Czy kiedykolwiek zastanawiałeś się, jak farmaceuta przygotowuje lekarstwo o precyzyjnej dawce? A może piekłeś ciasto, w którym proporcje składników mają kluczowe znaczenie dla smaku? Odpowiedź często kryje się w stężeniach roztworów, a konkretnie w stężeniu procentowym. Ten artykuł jest skierowany do uczniów, studentów i wszystkich osób zainteresowanych chemią i jej praktycznym zastosowaniem. Przyjrzymy się bliżej temu pojęciu, wyjaśniając, jak obliczać stężenie procentowe, jakie ma ono zastosowania i jakie pułapki mogą się pojawić podczas jego stosowania.
Co to jest stężenie procentowe?
Stężenie procentowe (Cp) to jeden ze sposobów wyrażania zawartości substancji w roztworze. Mówi nam, ile gramów substancji rozpuszczonej znajduje się w 100 gramach roztworu. Innymi słowy, stężenie procentowe określa procentową masę substancji rozpuszczonej w roztworze.
Definicja formalna: Stężenie procentowe (Cp) roztworu to liczba gramów substancji rozpuszczonej zawarta w 100 gramach roztworu.
Na przykład, roztwór 10% oznacza, że w 100 g roztworu znajduje się 10 g substancji rozpuszczonej.
Wzór na stężenie procentowe
Obliczenie stężenia procentowego jest proste, jeśli znamy masę substancji rozpuszczonej i masę roztworu. Wykorzystujemy następujący wzór:
Cp = (ms / mr) * 100%
Gdzie:
- Cp - stężenie procentowe
- ms - masa substancji rozpuszczonej (w gramach)
- mr - masa roztworu (w gramach)
Pamiętaj! Masa roztworu to suma masy substancji rozpuszczonej i masy rozpuszczalnika (najczęściej wody):
mr = ms + mrozp
Gdzie:
- mrozp - masa rozpuszczalnika (w gramach)
Przykłady obliczeń stężenia procentowego
Przykład 1:
Rozpuszczono 20 g cukru w 180 g wody. Oblicz stężenie procentowe roztworu.
Rozwiązanie:
- Określamy dane:
- ms = 20 g (masa cukru)
- mrozp = 180 g (masa wody)
- Obliczamy masę roztworu:
- mr = ms + mrozp = 20 g + 180 g = 200 g
- Obliczamy stężenie procentowe:
- Cp = (ms / mr) * 100% = (20 g / 200 g) * 100% = 10%
Odpowiedź: Stężenie procentowe roztworu wynosi 10%.
Przykład 2:
Ile gramów soli należy rozpuścić w 150 g wody, aby otrzymać roztwór 15%?
Rozwiązanie:
- Określamy dane:
- Cp = 15% (stężenie procentowe)
- mrozp = 150 g (masa wody)
- Wiemy, że Cp = (ms / mr) * 100%, oraz mr = ms + mrozp. Podstawiamy:
- 15% = (ms / (ms + 150 g)) * 100%
- Rozwiązujemy równanie względem ms:
- 0.15 = ms / (ms + 150 g)
- 0.15 * (ms + 150 g) = ms
- 0.15ms + 22.5 g = ms
- 22.5 g = 0.85ms
- ms = 22.5 g / 0.85 ≈ 26.47 g
Odpowiedź: Należy rozpuścić około 26.47 g soli.
Zastosowania stężenia procentowego
Stężenie procentowe znajduje szerokie zastosowanie w wielu dziedzinach. Oto kilka przykładów:
- Farmacja: Do przygotowywania leków o odpowiednich dawkach. Na przykład, krople do nosa o stężeniu 0,9% NaCl (roztwór fizjologiczny).
- Przemysł spożywczy: W produkcji napojów, słodyczy i innych produktów, gdzie precyzyjne proporcje składników są kluczowe dla smaku i jakości. Na przykład, stężenie cukru w syropach.
- Chemia laboratoryjna: Do przygotowywania odczynników chemicznych o określonych stężeniach do przeprowadzania reakcji chemicznych.
- Kosmetyka: W produkcji kremów, balsamów i innych kosmetyków, gdzie stężenie składników aktywnych wpływa na ich skuteczność. Na przykład, stężenie kwasu hialuronowego w serum.
- Rolnictwo: Do przygotowywania roztworów nawozów i środków ochrony roślin.
Pułapki i ważne uwagi
Podczas pracy ze stężeniem procentowym należy pamiętać o kilku ważnych kwestiach:
- Masa vs. Objętość: Stężenie procentowe dotyczy masy substancji rozpuszczonej i masy roztworu, a nie ich objętości. Częstym błędem jest mylenie masy z objętością, zwłaszcza w przypadku roztworów wodnych. Należy korzystać z gęstości, aby przeliczyć objętość na masę.
- Dokładność pomiarów: Dokładność pomiarów masy substancji rozpuszczonej i masy roztworu ma kluczowe znaczenie dla dokładności obliczonego stężenia procentowego. Używaj dokładnych wag laboratoryjnych.
- Temperatura: Gęstość roztworów zależy od temperatury. Stężenie procentowe pozostaje stałe, ale objętość roztworu może się zmieniać wraz z temperaturą.
- Roztwory stężone i rozcieńczone: Stężenie procentowe pozwala na łatwe porównywanie stężeń różnych roztworów. Roztwór o wyższym stężeniu procentowym zawiera więcej substancji rozpuszczonej w porównaniu do roztworu o niższym stężeniu procentowym.
Przeliczanie stężenia procentowego na inne jednostki
Stężenie procentowe można przeliczać na inne jednostki stężenia, takie jak stężenie molowe (mol/dm³) lub stężenie masowe (g/dm³). Przeliczenie to wymaga znajomości gęstości roztworu i masy molowej substancji rozpuszczonej.
Przykład przeliczenia Cp na stężenie molowe:
Załóżmy, że mamy roztwór 10% NaOH o gęstości 1.1 g/cm³. Oblicz stężenie molowe tego roztworu (masa molowa NaOH = 40 g/mol).
- Krok 1: Zdefiniuj dane: Cp = 10%, d = 1.1 g/cm³, M = 40 g/mol.
- Krok 2: 10% roztwór oznacza, że w 100 g roztworu znajduje się 10 g NaOH.
- Krok 3: Oblicz objętość 100 g roztworu: V = m/d = 100 g / (1.1 g/cm³) ≈ 90.91 cm³ = 0.09091 dm³.
- Krok 4: Oblicz liczbę moli NaOH w 10 g: n = m/M = 10 g / (40 g/mol) = 0.25 mol.
- Krok 5: Oblicz stężenie molowe: Cm = n/V = 0.25 mol / 0.09091 dm³ ≈ 2.75 mol/dm³.
Odpowiedź: Stężenie molowe roztworu wynosi około 2.75 mol/dm³.
Podsumowanie
Stężenie procentowe jest prostym i uniwersalnym sposobem wyrażania zawartości substancji w roztworze. Zrozumienie tego pojęcia i umiejętność jego obliczania jest niezwykle przydatne w wielu dziedzinach nauki i życia codziennego. Pamiętaj o dokładności pomiarów i właściwym posługiwaniu się wzorami. Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć, czym jest stężenie procentowe i jak je wykorzystywać w praktyce.
Teraz, gdy już wiesz, jak obliczyć stężenie procentowe, możesz z powodzeniem przygotowywać roztwory o określonych stężeniach, zarówno w laboratorium, jak i w domu. Powodzenia!