Równanie Dysocjacji Jonowej Kwasu Weglowego
Czy zastanawiałeś się kiedyś, dlaczego woda gazowana ma lekko kwaśny smak? Albo jak krew reguluje swoje pH, aby utrzymać nas przy życiu? Kluczem do tych procesów jest jeden związek chemiczny: kwas węglowy (H2CO3). Może brzmi to skomplikowanie, ale obiecuję, że wspólnie zrozumiemy, co się z nim dzieje w procesie, który nazywamy dysocjacją jonową.
Wiem, że chemia może wydawać się przerażająca, szczególnie dla osób, które nie mają z nią styczności na co dzień. Dlatego postaram się wytłumaczyć wszystko krok po kroku, używając prostego języka i przykładów z życia wziętych. Zrozumienie dysocjacji jonowej kwasu węglowego jest naprawdę ważne, ponieważ odgrywa on kluczową rolę w wielu procesach biologicznych i środowiskowych.
Co to jest Dysocjacja Jonowa?
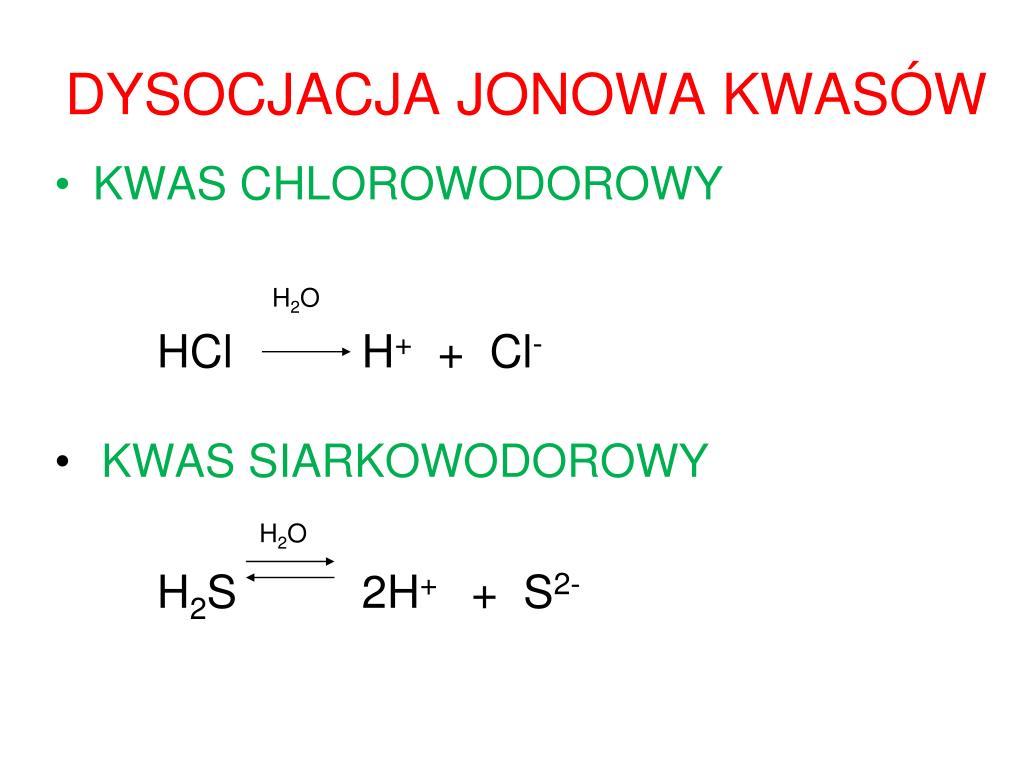
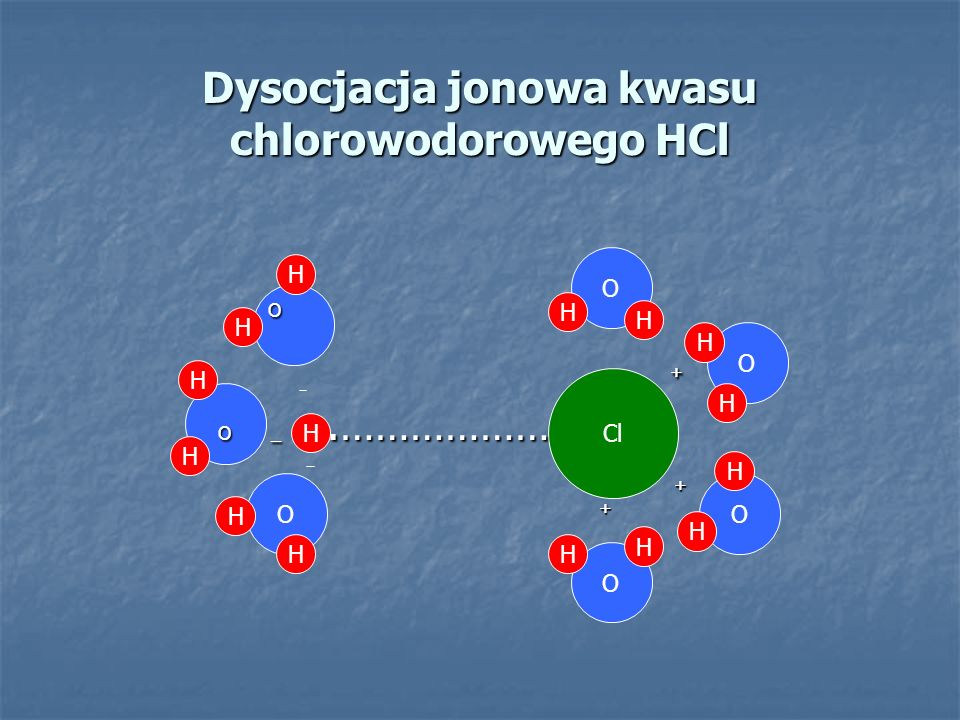
Najpierw zrozummy, czym w ogóle jest dysocjacja jonowa. Mówiąc najprościej, to proces rozpadu związku chemicznego na jony (cząstki naładowane elektrycznie) po rozpuszczeniu w wodzie. Weźmy na przykład sól kuchenną (NaCl). Kiedy wrzucimy ją do wody, rozpada się na jony sodu (Na+) i jony chlorkowe (Cl-). Podobnie dzieje się z kwasami, ale one uwalniają dodatkowo jony wodorowe (H+), które są odpowiedzialne za kwaśny odczyn.
W przypadku kwasu węglowego (H2CO3), proces ten jest nieco bardziej złożony, ponieważ kwas ten jest słaby i bardzo nietrwały. Oznacza to, że łatwo się rozkłada z powrotem do wody i dwutlenku węgla. Właśnie dlatego napoje gazowane tracą bąbelki – dwutlenek węgla ucieka z roztworu!
Równanie Dysocjacji Jonowej Kwasu Węglowego – Krok po Kroku
Teraz przejdźmy do konkretów, czyli jak wygląda równanie dysocjacji jonowej kwasu węglowego. Musimy pamiętać, że dysocjacja kwasu węglowego zachodzi etapami:
Etap 1: Pierwsza Dysocjacja
Kwas węglowy (H2CO3) rozpuszczony w wodzie częściowo dysocjuje na jon wodorowy (H+) i jon wodorowęglanowy (HCO3-).
Równanie chemiczne wygląda następująco:
H2CO3 ⇌ H+ + HCO3-
Zauważ, że używamy strzałki w obie strony (⇌). Oznacza to, że reakcja jest odwracalna. Kwas węglowy rozkłada się na jony, ale jony mogą również reagować ze sobą, tworząc z powrotem kwas węglowy. Jest to stan równowagi.
Etap 2: Druga Dysocjacja
Jon wodorowęglanowy (HCO3-) również może dysocjować, choć w znacznie mniejszym stopniu, na jon wodorowy (H+) i jon węglanowy (CO32-).
Równanie chemiczne:
HCO3- ⇌ H+ + CO32-
Ponownie, reakcja jest odwracalna i w znacznie mniejszym stopniu niż pierwsza dysocjacja. W roztworze dominuje przede wszystkim jon wodorowęglanowy (HCO3-).
Dlaczego to jest Ważne? – Rola w Naszym Ciele i Środowisku
Ok, mamy równania, ale po co nam to wszystko? Dlaczego powinniśmy się tym przejmować?
Bufor Węglanowy we Krwi: Najważniejszą rolą dysocjacji kwasu węglowego jest utrzymywanie stałego pH krwi. Krew musi mieć pH w wąskim zakresie (około 7.35-7.45), aby mogła prawidłowo funkcjonować. Bufor węglanowy, składający się z kwasu węglowego, jonów wodorowęglanowych i jonów węglanowych, działa jak amortyzator, który zapobiega gwałtownym zmianom pH. Kiedy pH krwi zaczyna spadać (staje się bardziej kwaśne), bufor wychwytuje nadmiar jonów H+. Kiedy pH zaczyna rosnąć (staje się bardziej zasadowe), bufor uwalnia jony H+. To niezwykle skomplikowany, ale doskonale działający system, który pozwala nam żyć.
Oddychanie: Dysocjacja kwasu węglowego jest ściśle związana z oddychaniem. Dwutlenek węgla (CO2), który produkujemy podczas oddychania komórkowego, jest transportowany we krwi częściowo w postaci kwasu węglowego i jonów wodorowęglanowych. Kiedy krew dociera do płuc, reakcja odwraca się, CO2 jest uwalniany i wydychany.
Wpływ na Klimat: Dwutlenek węgla w atmosferze rozpuszcza się w oceanach, tworząc kwas węglowy. Zwiększone stężenie CO2 w atmosferze (spowodowane działalnością człowieka) prowadzi do zakwaszenia oceanów, co ma negatywny wpływ na życie morskie, szczególnie na organizmy posiadające skorupy wapienne, takie jak koralowce.
Jak zapamiętać Równanie Dysocjacji Jonowej Kwasu Węglowego?
Pamiętanie równań chemicznych może być trudne, ale mam dla Ciebie kilka wskazówek:
- Zacznij od podstaw: Najpierw zapamiętaj wzór kwasu węglowego (H2CO3).
- Skup się na etapach: Pamiętaj, że dysocjacja zachodzi w dwóch etapach.
- Zrozum proces: Nie ucz się na pamięć, staraj się zrozumieć, co się dzieje podczas dysocjacji.
- Użyj mnemotechnik: Możesz spróbować wymyślić prostą historyjkę lub rymowankę, która pomoże Ci zapamiętać równania.
- Ćwicz: Im więcej będziesz pisać równania, tym łatwiej Ci będzie je zapamiętać.
Podsumowanie
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć, czym jest dysocjacja jonowa kwasu węglowego i dlaczego jest tak ważna. Zapamiętaj, że jest to proces rozpadu kwasu węglowego na jony wodorowe i wodorowęglanowe (a w niewielkim stopniu także węglanowe), który odgrywa kluczową rolę w regulacji pH krwi, oddychaniu i wpływa na środowisko naturalne.
Pamiętaj, chemia nie musi być straszna! Kluczem jest zrozumienie podstaw i łączenie teorii z praktycznymi przykładami. Jeśli nadal masz pytania, nie wahaj się szukać więcej informacji w Internecie lub skonsultować się z nauczycielem chemii.
Zrozumienie, jak działa kwas węglowy i jego dysocjacja jonowa pozwala lepiej zrozumieć, jak działa nasz organizm i jak nasze działania wpływają na naszą planetę. To wiedza, która daje nam większą świadomość i kontrolę nad naszym życiem.