Równania Reakcji Otrzymywania Wodorotlenków
Zmagasz się z równaniami reakcji chemicznych prowadzących do otrzymywania wodorotlenków? Czujesz, że balansowanie tych równań to prawdziwe wyzwanie, a zrozumienie mechanizmów reakcji jest poza Twoim zasięgu? Nie martw się, nie jesteś sam! Wielu uczniów i studentów ma podobne trudności. Ten artykuł został stworzony, aby pomóc Ci zrozumieć i opanować ten kluczowy aspekt chemii.
Wprowadzenie do Wodorotlenków
Wodorotlenki to związki chemiczne charakteryzujące się obecnością grupy hydroksylowej (-OH) połączonej z atomem metalu (w przypadku wodorotlenków metali) lub inną grupą funkcyjną (w przypadku wodorotlenków niemetali). Są to substancje szeroko stosowane w przemyśle, laboratoriach oraz w życiu codziennym. Znajomość metod ich otrzymywania jest fundamentalna dla każdego, kto zgłębia tajniki chemii.
Równania reakcji chemicznych stanowią zapis przebiegu reakcji za pomocą symboli i wzorów chemicznych, uwzględniający stechiometrię, czyli ilościowe relacje między substratami i produktami. Prawidłowo zbilansowane równanie jest kluczem do przewidywania ilości produktów, jakie powstaną w reakcji, oraz do zrozumienia mechanizmów zachodzących przemian.
Metody Otrzymywania Wodorotlenków
Istnieje kilka podstawowych metod otrzymywania wodorotlenków, a każda z nich opiera się na różnych reakcjach chemicznych. Poniżej omówimy najważniejsze z nich:
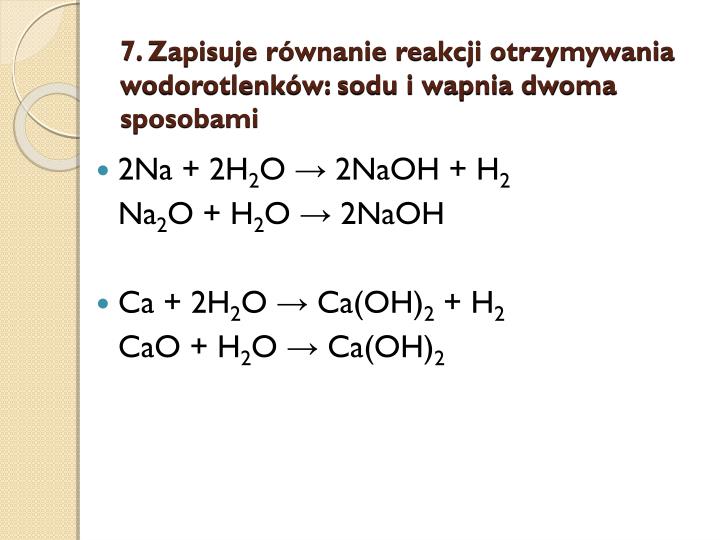
1. Reakcja Metalu z Wodą
Metale aktywne (np. lit, sód, potas, wapń) reagują bezpośrednio z wodą, tworząc wodorotlenek metalu i wodór.
Przykład:
2 Na(s) + 2 H2O(l) → 2 NaOH(aq) + H2(g)
W tym równaniu sód (Na) w stanie stałym reaguje z wodą (H2O) w stanie ciekłym, tworząc wodorotlenek sodu (NaOH) w roztworze wodnym i wodór (H2) w stanie gazowym.
Wskazówka: Pamiętaj, że reakcje metali z wodą mogą być bardzo gwałtowne, zwłaszcza w przypadku metali alkalicznych. Zawsze stosuj odpowiednie środki ostrożności w laboratorium!
2. Reakcja Tlenku Metalu z Wodą
Tlenki metali alkalicznych i ziem alkalicznych reagują z wodą, tworząc odpowiednie wodorotlenki.
Przykład:
CaO(s) + H2O(l) → Ca(OH)2(aq)
Tlenek wapnia (CaO) w stanie stałym reaguje z wodą (H2O) w stanie ciekłym, tworząc wodorotlenek wapnia (Ca(OH)2) w roztworze wodnym. Wodorotlenek wapnia jest znany również jako woda wapienna.
3. Reakcja Soli z Wodorotlenkiem
Reakcja soli z wodorotlenkiem, zazwyczaj w roztworze wodnym, prowadzi do powstania nowego wodorotlenku i nowej soli. Reakcja ta zachodzi, gdy jeden z produktów jest nierozpuszczalny w wodzie (wydziela się osad).
Przykład:
CuSO4(aq) + 2 NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq)
Siarczan miedzi(II) (CuSO4) w roztworze wodnym reaguje z wodorotlenkiem sodu (NaOH) w roztworze wodnym, tworząc wodorotlenek miedzi(II) (Cu(OH)2) w postaci osadu i siarczan sodu (Na2SO4) w roztworze wodnym.
Pamiętaj! Kluczem do sukcesu jest znajomość tabeli rozpuszczalności soli i wodorotlenków w wodzie. Dzięki niej będziesz w stanie przewidzieć, czy dana reakcja zajdzie.
4. Elektroliza Roztworów Soli
Elektroliza roztworów niektórych soli, zwłaszcza chlorków metali alkalicznych, prowadzi do powstania wodorotlenków, chloru i wodoru.
Przykład:
2 NaCl(aq) + 2 H2O(l) → 2 NaOH(aq) + Cl2(g) + H2(g)
Chlorek sodu (NaCl) w roztworze wodnym poddany elektrolizie ulega rozkładowi na wodorotlenek sodu (NaOH), chlor (Cl2) i wodór (H2). Ta metoda jest szeroko stosowana w przemyśle do produkcji wodorotlenku sodu.
Bilansowanie Równań Reakcji
Bilansowanie równań reakcji chemicznych jest kluczowe dla zachowania prawa zachowania masy. Oznacza to, że liczba atomów każdego pierwiastka po stronie substratów musi być równa liczbie atomów tego samego pierwiastka po stronie produktów.
Kroki bilansowania równań:
- Zapisz równanie reakcji, używając prawidłowych wzorów chemicznych substratów i produktów.
- Policz liczbę atomów każdego pierwiastka po obu stronach równania.
- Dobierz współczynniki stechiometryczne przed wzorami chemicznymi, tak aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania.
- Sprawdź, czy równanie jest zbilansowane.
Przykład: Bilansowanie równania reakcji tlenku sodu z wodą:
Na2O + H2O → NaOH
- Liczba atomów Na po lewej stronie: 2, po prawej stronie: 1
- Liczba atomów O po lewej stronie: 2, po prawej stronie: 1
- Liczba atomów H po lewej stronie: 2, po prawej stronie: 1
Aby zbilansować równanie, umieszczamy współczynnik 2 przed wzorem NaOH:
Na2O + H2O → 2 NaOH
- Liczba atomów Na po lewej stronie: 2, po prawej stronie: 2
- Liczba atomów O po lewej stronie: 2, po prawej stronie: 2
- Liczba atomów H po lewej stronie: 2, po prawej stronie: 2
Równanie jest teraz zbilansowane.
Przykłady Równań Reakcji z Zastosowaniem
Poniżej przedstawiono kilka przykładów równań reakcji otrzymywania wodorotlenków wraz z ich zastosowaniem:
- Otrzymywanie wodorotlenku sodu (NaOH): Wykorzystywany w przemyśle papierniczym, tekstylnym, chemicznym (produkcja mydła, detergentów, barwników). Otrzymywany przez elektrolizę roztworu chlorku sodu (opisana powyżej).
- Otrzymywanie wodorotlenku potasu (KOH): Stosowany w produkcji mydeł potasowych, elektrolitów w akumulatorach, w rolnictwie jako nawóz. Otrzymywany podobnie jak NaOH, przez elektrolizę roztworu chlorku potasu.
- Otrzymywanie wodorotlenku wapnia (Ca(OH)2): Używany w budownictwie (zaprawa wapienna), rolnictwie (neutralizacja kwasowości gleby), oczyszczaniu ścieków. Otrzymywany przez reakcję tlenku wapnia z wodą (gaszenie wapna).
- Otrzymywanie wodorotlenku magnezu (Mg(OH)2): Stosowany w medycynie jako lek zobojętniający kwas żołądkowy, w przemyśle jako dodatek do tworzyw sztucznych. Otrzymywany przez reakcję soli magnezu z wodorotlenkami metali alkalicznych.
Typowe Błędy i Jak Ich Unikać
Podczas pisania równań reakcji chemicznych często popełniane są następujące błędy:
- Nieprawidłowe wzory chemiczne: Upewnij się, że znasz i poprawnie zapisujesz wzory chemiczne substratów i produktów.
- Niezbilansowane równania: Zawsze sprawdzaj, czy liczba atomów każdego pierwiastka jest taka sama po obu stronach równania.
- Brak stanu skupienia: Pamiętaj o zapisywaniu stanu skupienia substancji (s - stały, l - ciekły, g - gazowy, aq - roztwór wodny).
- Zapominanie o warunkach reakcji: Niektóre reakcje wymagają specyficznych warunków (temperatura, ciśnienie, katalizator).
Aby uniknąć tych błędów, poświęć czas na powtórkę podstawowych zasad nomenklatury chemicznej i stechiometrii. Regularne rozwiązywanie zadań i analiza przykładów pomoże Ci utrwalić zdobytą wiedzę.
Podsumowanie
Opanowanie równań reakcji otrzymywania wodorotlenków jest kluczowe dla zrozumienia podstaw chemii. Pamiętaj o regularnej praktyce, systematycznym powtarzaniu materiału i korzystaniu z dostępnych źródeł wiedzy. Zrozumienie podstawowych metod otrzymywania, zasad bilansowania równań i świadomość typowych błędów pozwoli Ci na skuteczne rozwiązywanie problemów chemicznych. Nie zrażaj się trudnościami! Z każdym rozwiązanym równaniem będziesz coraz bliżej sukcesu.
Pamiętaj, że chemia to nie tylko wzory i równania, ale przede wszystkim fascynująca dziedzina nauki, która pozwala zrozumieć świat wokół nas. Powodzenia!
"Chemia to nauka o strukturze, właściwościach, składzie, reakcjach i syntezie substancji oraz o energii związanej z tymi procesami." - Linus Pauling, dwukrotny laureat Nagrody Nobla.








