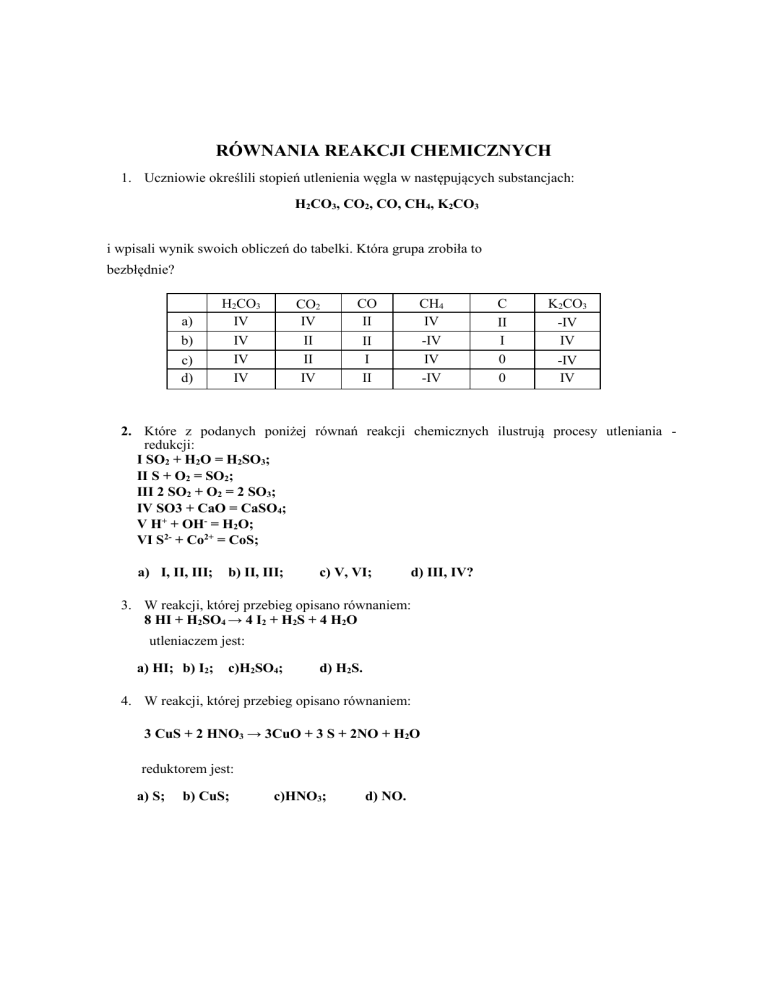
Równania Reakcji Chemicznych Przykłady I Rozwiązania

Dzień dobry wszystkim! Dzisiaj zajmiemy się równaniami reakcji chemicznych. Spróbujemy zrozumieć, jak je zapisywać i rozwiązywać, posługując się kilkoma przykładami.
Zacznijmy od podstaw. Równanie reakcji chemicznej to nic innego jak zapis tego, co się dzieje, kiedy różne substancje ze sobą reagują. Mamy substraty (to, co wkładamy na początku) i produkty (to, co otrzymujemy na końcu). Strzałka w równaniu pokazuje kierunek przemiany.
Prosty przykład:
Wyobraźcie sobie, że mamy wodór (H₂) i tlen (O₂). One reagują ze sobą, tworząc wodę (H₂O). Zapiszemy to tak:
H₂ + O₂ → H₂O
Widzimy, co wchodzi (wodór i tlen) i co wychodzi (woda). Ale... coś tu nie gra. Spójrzmy na to uważniej. Po lewej stronie mamy 2 atomy wodoru i 2 atomy tlenu. Po prawej stronie mamy 2 atomy wodoru i tylko 1 atom tlenu. Prawo zachowania masy mówi nam, że atomy nie znikają i nie pojawiają się znikąd. Musimy więc doprowadzić do tego, żeby po obu stronach było ich tyle samo.
Uzgadnianie równań
Uzgadnianie równań polega na dodawaniu współczynników stechiometrycznych przed wzorami chemicznymi. Są to liczby, które mówią nam, ile cząsteczek danej substancji bierze udział w reakcji.
Wracając do naszego przykładu:
H₂ + O₂ → H₂O
Widzimy, że brakuje nam tlenu po prawej stronie. Dodajmy więc współczynnik 2 przed wodą:
H₂ + O₂ → 2H₂O
Teraz mamy 2 atomy tlenu po lewej i 2 atomy tlenu po prawej stronie. Tlen jest w porządku. Ale... co z wodorem? Po lewej stronie mamy 2 atomy wodoru, a po prawej mamy 2 * 2 = 4 atomy wodoru. Znowu nierównowaga. Musimy dodać współczynnik 2 przed wodorem po lewej stronie:
2H₂ + O₂ → 2H₂O
Teraz wszystko się zgadza. Mamy 4 atomy wodoru i 2 atomy tlenu po obu stronach równania. Równanie jest uzgodnione!
Inny przykład: Spalanie metanu
Metan (CH₄) to główny składnik gazu ziemnego. Kiedy go spalimy (czyli zareaguje z tlenem), powstaje dwutlenek węgla (CO₂) i woda (H₂O). Zapiszemy to tak:
CH₄ + O₂ → CO₂ + H₂O
Znowu musimy uzgodnić to równanie. Zaczynamy od węgla. Po lewej stronie mamy 1 atom węgla, a po prawej też 1 atom węgla. Węgiel jest w porządku.
Teraz wodór. Po lewej stronie mamy 4 atomy wodoru, a po prawej 2 atomy wodoru. Dodajmy współczynnik 2 przed wodą:
CH₄ + O₂ → CO₂ + 2H₂O
Teraz mamy 4 atomy wodoru po obu stronach. Wodór jest w porządku.
Na koniec tlen. Po lewej stronie mamy 2 atomy tlenu, a po prawej mamy 2 (w CO₂) + 2 (w 2H₂O) = 4 atomy tlenu. Dodajmy współczynnik 2 przed tlenem po lewej stronie:
CH₄ + 2O₂ → CO₂ + 2H₂O
Teraz mamy 4 atomy tlenu po obu stronach. Równanie jest uzgodnione!
Rozpuszczanie chlorku sodu (soli kuchennej) w wodzie
Chlorek sodu (NaCl) to sól kuchenna. Kiedy wrzucimy ją do wody (H₂O), rozpuszcza się. To proces fizyczny, ale możemy go zapisać jako równanie:
NaCl (s) → Na⁺ (aq) + Cl⁻ (aq)
(s) oznacza, że chlorek sodu jest w stanie stałym, a (aq) oznacza, że jony sodu i chloru są rozpuszczone w wodzie (roztwór wodny). To równanie jest już uzgodnione, bo mamy po jednym atomie sodu i chloru po obu stronach.
Reakcja kwasu z zasadą
Weźmy na przykład reakcję kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH). Powstaje chlorek sodu (NaCl) i woda (H₂O). Zapiszemy to tak:
HCl + NaOH → NaCl + H₂O
To równanie jest już uzgodnione! Mamy po jednym atomie wodoru, chloru, sodu i tlenu po obu stronach.
Ważne wskazówki:
- Zawsze sprawdzaj, czy po obu stronach równania masz tyle samo atomów każdego pierwiastka.
- Zacznij uzgadnianie od pierwiastków, które występują tylko w jednym związku po każdej stronie równania.
- Pamiętaj, że współczynniki stechiometryczne to liczby, które mnożymy przez całe wzory chemiczne.
- Ćwicz! Im więcej równań spróbujesz uzgodnić, tym lepiej to zrozumiesz.
Przykłady bardziej zaawansowane
Spróbujmy czegoś trochę trudniejszego:
KMnO₄ + HCl → KCl + MnCl₂ + H₂O + Cl₂
To jest reakcja redoks (utleniania-redukcji). Uzgodnienie takiego równania wymaga trochę więcej wysiłku. Zacznijmy od pierwiastków, które zmieniają stopień utlenienia, czyli manganu (Mn) i chloru (Cl).
Po lewej stronie Mn ma stopień utlenienia +7 (w KMnO₄), a po prawej +2 (w MnCl₂). Zatem mangan redukuje się, pobierając 5 elektronów.
Chlor po lewej stronie (w HCl) ma stopień utlenienia -1. Po prawej stronie mamy chlor w Cl₂, gdzie ma stopień utlenienia 0. Zatem część chloru utlenia się, oddając 1 elektron.
Musimy znaleźć najmniejszą wspólną wielokrotność liczby oddanych i pobranych elektronów, czyli 5. To oznacza, że potrzebujemy 1 cząsteczki KMnO₄ (bo pobiera 5 elektronów) i 5 atomów chloru, które utlenią się do Cl₂. Ale chlor występuje w HCl, więc będziemy potrzebować więcej niż 5 cząsteczek HCl.
Najpierw uzgodnijmy mangan:
2KMnO₄ + HCl → KCl + 2MnCl₂ + H₂O + Cl₂
Dodaliśmy 2 przed KMnO₄ i 2 przed MnCl₂, aby wyrównać ilość manganu. Teraz zajmijmy się potasem (K). Mamy 2 atomy potasu po lewej stronie, więc musimy dodać 2 przed KCl:
2KMnO₄ + HCl → 2KCl + 2MnCl₂ + H₂O + Cl₂
Teraz musimy uzgodnić chlor. Po prawej stronie mamy 2 (w 2KCl) + 4 (w 2MnCl₂) = 6 atomów chloru plus chlor w Cl₂, którego jeszcze nie znamy. Trudno w tym momencie oszacować ilość HCl, więc przejdźmy do uzgadniania tlenu.
Po lewej stronie mamy 8 atomów tlenu (w 2KMnO₄). Musimy więc dodać 8 przed wodą:
2KMnO₄ + HCl → 2KCl + 2MnCl₂ + 8H₂O + Cl₂
Teraz uzgodnijmy wodór. Po prawej stronie mamy 16 atomów wodoru (w 8H₂O). Musimy więc dodać 16 przed HCl:
2KMnO₄ + 16HCl → 2KCl + 2MnCl₂ + 8H₂O + Cl₂
Teraz policzmy chlor. Po lewej stronie mamy 16 atomów chloru (w 16HCl). Po prawej stronie mamy 2 (w 2KCl) + 4 (w 2MnCl₂) = 6 atomów chloru. Zatem w Cl₂ musi być 16 - 6 = 10 atomów chloru, czyli 5 cząsteczek Cl₂:
2KMnO₄ + 16HCl → 2KCl + 2MnCl₂ + 8H₂O + 5Cl₂
Sprawdźmy jeszcze raz. 2 atomy potasu po obu stronach, 2 atomy manganu po obu stronach, 8 atomów tlenu po obu stronach, 16 atomów wodoru po obu stronach i 16 atomów chloru po obu stronach. Równanie jest uzgodnione!
Podsumowanie
Uzgadnianie równań reakcji chemicznych to ważna umiejętność w chemii. Wymaga ona trochę praktyki, ale z czasem staje się coraz łatwiejsza. Pamiętaj o prawie zachowania masy i zawsze sprawdzaj, czy po obu stronach równania masz tyle samo atomów każdego pierwiastka. Nie zrażaj się trudnościami i ćwicz regularnie. Powodzenia!