Reszta Kwasowa Jak Obliczyć

Reszta kwasowa, znana również jako anion kwasowy, to kluczowy element w chemii kwasów. Zrozumienie, jak obliczyć resztę kwasową, jest fundamentalne dla prawidłowego pisania wzorów chemicznych soli, przewidywania reakcji chemicznych i interpretowania wyników analiz laboratoryjnych. W tym artykule szczegółowo omówimy, czym jest reszta kwasowa, jak ją obliczyć i jakie ma znaczenie w praktyce.
Czym jest Reszta Kwasowa?
Reszta kwasowa to fragment cząsteczki kwasu, który pozostaje po odłączeniu od niego jonów wodorowych (H+). Każdy kwas, niezależnie od swojej mocy, posiada charakterystyczną resztę kwasową. Ta reszta, po połączeniu z kationem metalu lub jonem amonowym (NH4+), tworzy sól. Zatem, reszta kwasowa jest anionem (jonem ujemnym) w soli.
Podstawowe Pojęcia:
Zanim przejdziemy do obliczeń, upewnijmy się, że rozumiemy kilka kluczowych pojęć:
- Kwas: Związek chemiczny, który w roztworze wodnym dysocjuje na jony wodorowe (H+) i resztę kwasową.
- Dysocjacja: Proces rozpadu związku chemicznego na jony w roztworze.
- Anion: Jon naładowany ujemnie.
- Sól: Związek chemiczny powstały w wyniku reakcji kwasu z zasadą lub metalem.
Jak Obliczyć Resztę Kwasową - Krok po Kroku
Obliczanie reszty kwasowej jest stosunkowo proste, jeśli znamy wzór kwasu. Proces sprowadza się do usunięcia z wzoru kwasu jonów wodorowych (H+) i uwzględnienia odpowiedniego ładunku ujemnego. Liczba ładunków ujemnych odpowiada liczbie usuniętych jonów wodorowych.
Krok 1: Określ Wzór Kwasu
Pierwszym krokiem jest ustalenie wzoru chemicznego kwasu. Informację tę możemy znaleźć w tablicach chemicznych, podręcznikach lub w internecie. Przykładowe kwasy i ich wzory:
- Kwas solny (chlorowodorowy): HCl
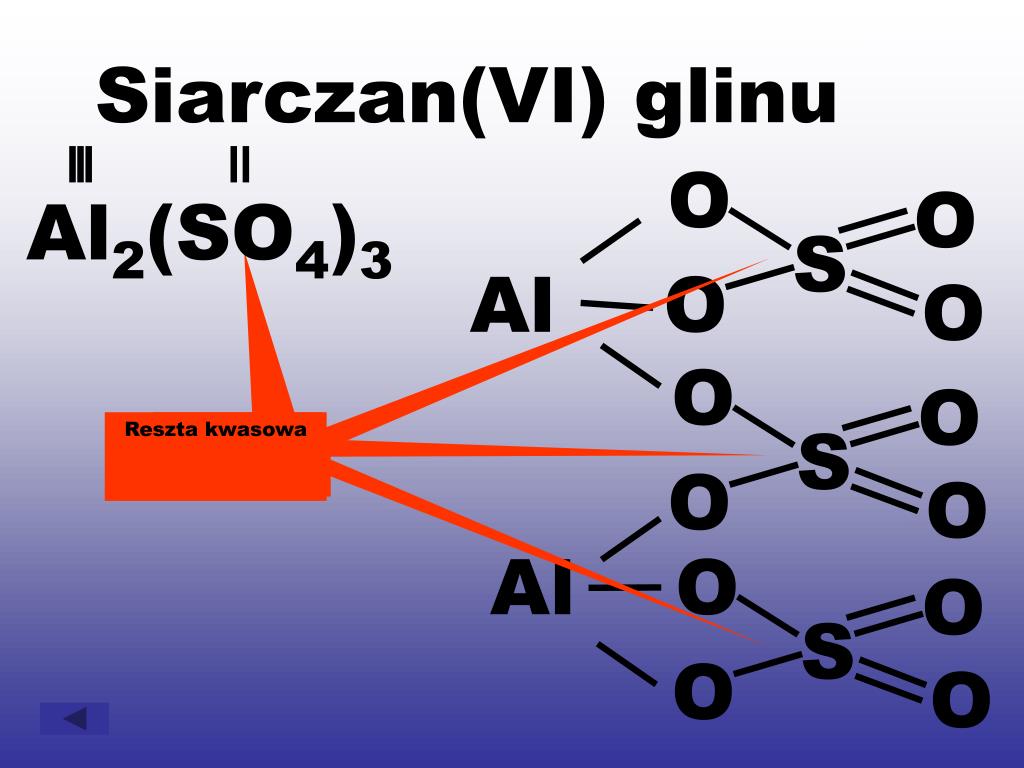
- Kwas siarkowy(VI): H2SO4
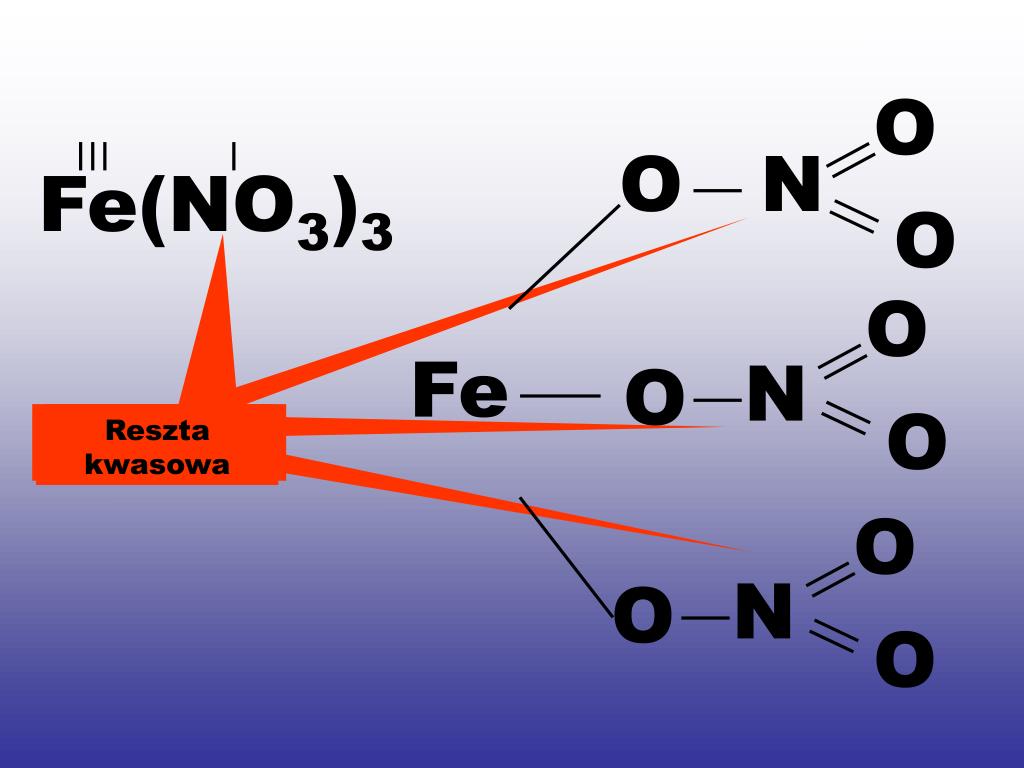
- Kwas azotowy(V): HNO3
- Kwas fosforowy(V): H3PO4
- Kwas węglowy: H2CO3
Krok 2: Określ Liczbę Jonów Wodorowych
Następnie, należy ustalić, ile jonów wodorowych (H+) może oddać dany kwas. Liczba ta zależy od liczby atomów wodoru związanych z atomami tlenu w kwasie. Na przykład:
- HCl oddaje 1 jon H+
- H2SO4 oddaje 2 jony H+
- HNO3 oddaje 1 jon H+
- H3PO4 oddaje 3 jony H+
- H2CO3 oddaje 2 jony H+
Krok 3: Usuń Jony Wodorowe i Dodaj Ładunek Ujemny
Ostatnim krokiem jest usunięcie ze wzoru kwasu odpowiedniej liczby jonów wodorowych i dodanie ładunku ujemnego odpowiadającego liczbie usuniętych H+. Poniżej przedstawiono, jak to zrobić dla wspomnianych wcześniej kwasów:
- HCl → Cl- (chlorek)
- H2SO4 → SO42- (siarczan(VI))
- HNO3 → NO3- (azotan(V))
- H3PO4 → PO43- (fosforan(V))
- H2CO3 → CO32- (węglan)
Zwróć uwagę, że liczba ładunków ujemnych na reszcie kwasowej jest zawsze równa liczbie jonów wodorowych, które kwas oddaje.
Przykłady Obliczania Reszt Kwasowych
Przyjrzyjmy się kilku dodatkowym przykładom, aby utrwalić proces obliczania reszt kwasowych:
Przykład 1: Kwas Octowy (CH3COOH)
Kwas octowy oddaje jeden jon wodorowy (H+) z grupy karboksylowej (-COOH). Zatem, jego reszta kwasowa to:
CH3COOH → CH3COO- (octan)
Przykład 2: Kwas Siarkowy(IV) (H2SO3)
Kwas siarkowy(IV) oddaje dwa jony wodorowe (H+). Zatem, jego reszta kwasowa to:
H2SO3 → SO32- (siarczan(IV), siarczyn)
Przykład 3: Kwas Fluorowodorowy (HF)
Kwas fluorowodorowy oddaje jeden jon wodorowy (H+). Zatem, jego reszta kwasowa to:
HF → F- (fluorek)
Znaczenie Reszt Kwasowych w Solach
Reszty kwasowe odgrywają kluczową rolę w budowie i właściwościach soli. Sól składa się z kationu (jonu dodatniego) i anionu (reszty kwasowej). Nazwa soli pochodzi od nazwy reszty kwasowej i nazwy kationu. Na przykład:
- NaCl (chlorek sodu) - składa się z kationu sodu (Na+) i reszty kwasowej chlorkowej (Cl-) pochodzącej od kwasu solnego (HCl).
- CaSO4 (siarczan(VI) wapnia) - składa się z kationu wapnia (Ca2+) i reszty kwasowej siarczanowej(VI) (SO42-) pochodzącej od kwasu siarkowego(VI) (H2SO4).
- KNO3 (azotan(V) potasu) - składa się z kationu potasu (K+) i reszty kwasowej azotanowej(V) (NO3-) pochodzącej od kwasu azotowego(V) (HNO3).
Właściwości soli, takie jak rozpuszczalność w wodzie, pH roztworu i zdolność do reagowania z innymi substancjami, zależą od rodzaju kationu i anionu (czyli reszty kwasowej) wchodzących w jej skład.
Przykłady Zastosowań w Życiu Codziennym i Przemysle
Znajomość reszt kwasowych jest niezwykle ważna w wielu dziedzinach życia i przemysłu. Oto kilka przykładów:
- Rolnictwo: Nawozy sztuczne często zawierają sole z resztami kwasowymi, takimi jak azotany(V) (NO3-), fosforany(V) (PO43-) i siarczany(VI) (SO42-), które dostarczają roślinom niezbędne składniki odżywcze.
- Medycyna: Wiele leków to sole zawierające reszty kwasowe. Na przykład, aspiryna (kwas acetylosalicylowy) zawiera resztę kwasu octowego. Sole magnezowe, takie jak siarczan(VI) magnezu (MgSO4), są stosowane jako środki przeczyszczające.
- Przemysł chemiczny: Reszty kwasowe są wykorzystywane w syntezie wielu związków chemicznych, w procesach rafinacji ropy naftowej, produkcji tworzyw sztucznych i wielu innych.
- Oczyszczanie wody: Sole glinu i żelaza, zawierające reszty kwasowe, są używane jako koagulanty w procesach uzdatniania wody.
- Żywność: Wiele dodatków do żywności to sole zawierające reszty kwasowe. Na przykład, benzoesan sodu (C6H5COONa) jest stosowany jako konserwant.
Dlaczego Ważne jest Zrozumienie Reszt Kwasowych?
Zrozumienie, czym są reszty kwasowe i jak je obliczać, jest kluczowe z kilku powodów:
- Prawidłowe pisanie wzorów chemicznych: Znajomość reszt kwasowych pozwala na poprawne zapisywanie wzorów soli i przewidywanie ich właściwości.
- Przewidywanie reakcji chemicznych: Wiele reakcji chemicznych, zwłaszcza reakcji wymiany, polega na wymianie jonów między związkami. Znajomość reszt kwasowych pozwala przewidywać, jakie produkty powstaną w wyniku reakcji.
- Interpretacja wyników analiz laboratoryjnych: W analizach laboratoryjnych często oznaczane są stężenia różnych jonów, w tym reszt kwasowych. Zrozumienie, co te reszty oznaczają i skąd pochodzą, jest niezbędne do interpretacji wyników.
- Rozwiązywanie problemów chemicznych: Wiele problemów chemicznych, zwłaszcza tych związanych z stechiometrią i równowagą chemiczną, wymaga znajomości reszt kwasowych.
Podsumowanie
Reszta kwasowa to anion pochodzący od kwasu, który powstaje po odłączeniu jonów wodorowych. Obliczanie reszty kwasowej polega na usunięciu jonów H+ ze wzoru kwasu i dodaniu odpowiedniego ładunku ujemnego. Znajomość reszt kwasowych jest niezbędna do prawidłowego pisania wzorów chemicznych soli, przewidywania reakcji chemicznych i interpretowania wyników analiz laboratoryjnych. Mam nadzieję, że ten artykuł pomógł Ci zrozumieć, czym są reszty kwasowe i jak je obliczać.
Zachęcam do dalszego zgłębiania wiedzy z zakresu chemii! Spróbuj rozwiązać więcej przykładów obliczania reszt kwasowych i analizuj wzory różnych soli. Wiedza o resztach kwasowych jest fundamentalna i otworzy przed Tobą drzwi do dalszego zrozumienia świata chemii!