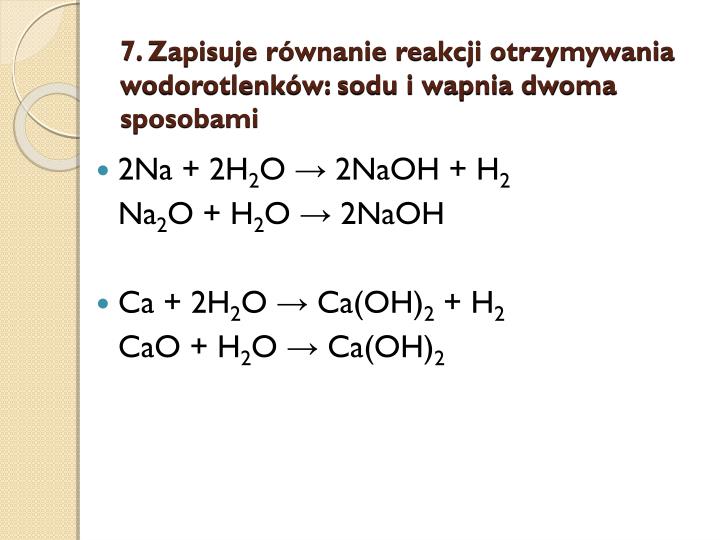
Reakcje Z Wodorotlenkami

Zastanawiałeś się kiedyś, dlaczego mydło działa? Albo jak powstają niektóre rodzaje nawozów? Często odpowiedź kryje się w fascynującym świecie reakcji chemicznych, a dokładniej – reakcji z wodorotlenkami. Jeśli chemia zawsze wydawała Ci się tajemnicza i skomplikowana, nie martw się! Ten artykuł ma za zadanie przybliżyć Ci ten temat w sposób jasny i zrozumiały, pokazując, że reakcje z wodorotlenkami są obecne w wielu aspektach naszego codziennego życia.
Czym są wodorotlenki?
Zacznijmy od podstaw. Wodorotlenki to związki chemiczne, które zawierają grupę hydroksylową (OH-). Ta grupa to nic innego jak atom tlenu połączony z atomem wodoru, niosący ładunek ujemny. Najczęściej spotykane wodorotlenki to te metali alkalicznych (np. wodorotlenek sodu - NaOH) i metali ziem alkalicznych (np. wodorotlenek wapnia - Ca(OH)2). Ważne jest, aby pamiętać, że wodorotlenki są związkami jonowymi, co oznacza, że w roztworach wodnych dysocjują na jony – kation metalu i anion wodorotlenkowy.
Podstawowe właściwości wodorotlenków
Wodorotlenki, zwłaszcza te rozpuszczalne w wodzie, czyli zasady, charakteryzują się kilkoma kluczowymi właściwościami:
- Mają odczyn zasadowy: To oznacza, że ich roztwory mają pH powyżej 7.
- Są śliskie w dotyku: Należy jednak pamiętać, że kontakt z silnymi zasadami może być niebezpieczny i powodować oparzenia.
- Reagują z kwasami: Ta reakcja nazywana jest neutralizacją i prowadzi do powstania soli i wody.
- Reagują z niektórymi metalami i niemetalami.
Rodzaje reakcji z wodorotlenkami
Wodorotlenki wchodzą w różnorodne reakcje chemiczne. Przyjrzyjmy się kilku z nich:
1. Reakcja neutralizacji
To jedna z najbardziej znanych reakcji z udziałem wodorotlenków. Polega na reakcji kwasu z zasadą. Efektem jest zobojętnienie (neutralizacja) właściwości kwasowych i zasadowych, prowadzące do powstania soli i wody. Przykładowo:
HCl (kwas solny) + NaOH (wodorotlenek sodu) → NaCl (chlorek sodu) + H2O (woda)
Reakcja neutralizacji ma ogromne znaczenie w przemyśle (np. przy oczyszczaniu ścieków), w medycynie (np. leki na zgagę neutralizują kwas żołądkowy) oraz w życiu codziennym (np. przy usuwaniu plam kwasowych).
2. Reakcja z tlenkami kwasowymi
Tlenki kwasowe, to tlenki niemetali, które po reakcji z wodą tworzą kwasy. Reagują z wodorotlenkami tworząc sole i wodę. Na przykład:
CO2 (dwutlenek węgla) + 2KOH (wodorotlenek potasu) → K2CO3 (węglan potasu) + H2O (woda)
Ta reakcja jest ważna w kontekście pochłaniania dwutlenku węgla, np. w specjalnych filtrach przemysłowych. W przyrodzie podobny proces zachodzi podczas wietrzenia skał.
3. Reakcja z tlenkami amfoterycznymi
Tlenki amfoteryczne, takie jak tlenek glinu (Al2O3) lub tlenek cynku (ZnO), reagują zarówno z kwasami, jak i z zasadami. W reakcji z wodorotlenkami tworzą związki kompleksowe, zwane glinianami i cynkanami. Na przykład:
Al2O3 (tlenek glinu) + 2NaOH (wodorotlenek sodu) + 3H2O → 2Na[Al(OH)4] (tetrahydroksoglinian sodu)
Reakcje te są wykorzystywane w przemyśle chemicznym i metalurgicznym, m.in. przy ekstrakcji glinu z boksytów (rudy glinu).
4. Reakcja z solami
Wodorotlenki mogą reagować z solami, prowadząc do wytrącania się osadów nierozpuszczalnych wodorotlenków lub innych soli. Przykładowo:
CuSO4 (siarczan(VI) miedzi(II)) + 2NaOH (wodorotlenek sodu) → Cu(OH)2 (wodorotlenek miedzi(II)) ↓ + Na2SO4 (siarczan(VI) sodu)
W tym przypadku wytrąca się osad wodorotlenku miedzi(II), który ma charakterystyczny niebieski kolor. Te reakcje są szeroko wykorzystywane w analizie jakościowej do identyfikacji jonów metali.
5. Reakcja zmydlania tłuszczów
To bardzo ważna reakcja w kontekście produkcji mydła. Polega na hydrolizie tłuszczów (estry glicerolu i wyższych kwasów tłuszczowych) pod wpływem wodorotlenków (np. wodorotlenku sodu lub potasu). Produktami tej reakcji są mydła (sole wyższych kwasów tłuszczowych) i glicerol. Na przykład:
(Tłuszcz) + 3NaOH (wodorotlenek sodu) → 3 (Mydło – np. stearynian sodu) + Glicerol
Mydła, dzięki swojej strukturze, mają właściwości amfifilowe, czyli posiadają część hydrofilową (lubiącą wodę) i hydrofobową (nie lubiącą wody). Dzięki temu usuwają brud i tłuszcz z powierzchni.
Wpływ reakcji z wodorotlenkami na środowisko
Reakcje z wodorotlenkami mają istotny wpływ na środowisko naturalne. Na przykład, zakwaszenie gleby (spowodowane np. kwaśnymi deszczami) może być neutralizowane poprzez dodanie wodorotlenku wapnia (wapnowanie). Z drugiej strony, niekontrolowane uwalnianie wodorotlenków do środowiska może prowadzić do wzrostu pH wody i gleby, co negatywnie wpływa na rośliny i zwierzęta.
Przemysł również ma duży wpływ na środowisko poprzez emisję związków, które reagują z wodorotlenkami obecnymi w wodzie i glebie. Dlatego tak ważne jest odpowiedzialne gospodarowanie zasobami i stosowanie technologii, które minimalizują negatywny wpływ na środowisko.
Zastosowania w życiu codziennym
Jak widzisz, reakcje z wodorotlenkami są wszechobecne w naszym życiu. Oto kilka przykładów:
- Środki czystości: Wiele środków czystości, takich jak płyny do udrażniania rur czy środki do czyszczenia piekarników, zawiera wodorotlenki (np. wodorotlenek sodu), które reagują z tłuszczami i innymi zanieczyszczeniami, ułatwiając ich usunięcie.
- Leki: Leki na zgagę zawierają związki, które neutralizują kwas żołądkowy, łagodząc dolegliwości.
- Kosmetyki: W niektórych kosmetykach, np. kremach do depilacji, wykorzystuje się właściwości wodorotlenków do rozpuszczania włosów.
- Przemysł spożywczy: Wodorotlenki są wykorzystywane w procesach produkcyjnych wielu produktów spożywczych, np. przy produkcji czekolady, gdzie wodorotlenek potasu jest używany do alkalizacji ziaren kakaowych.
Podsumowując, reakcje z wodorotlenkami to fascynujący i niezwykle ważny obszar chemii. Odgrywają one kluczową rolę w wielu procesach przemysłowych, w ochronie środowiska oraz w naszym codziennym życiu. Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć ten temat i pokazał, że chemia wcale nie musi być taka straszna!