Reakcje W Roztworach Wodnych Sprawdzian

Witajcie, przyszli chemicy! Przed Wami sprawdzian z reakcji w roztworach wodnych? Bez obaw, jestem tu, żeby Wam pomóc! Ten przewodnik pomoże Wam uporządkować wiedzę i poczuć się pewniej przed egzaminem. Skupimy się na najważniejszych zagadnieniach, tłumacząc je w przystępny sposób. Gotowi? Zaczynamy!
Podstawowe Pojęcia i Definicje
Zanim przejdziemy do konkretnych typów reakcji, musimy upewnić się, że rozumiemy kilka podstawowych pojęć. Pamiętajcie, chemia to język, a my musimy go opanować!
Roztwory Wodne
Roztwór wodny to mieszanina, w której rozpuszczalnikiem jest woda. Woda jest świetnym rozpuszczalnikiem ze względu na swoją polarność, co pozwala jej efektywnie oddziaływać z substancjami jonowymi i polarnymi. Rozpuszczalnik to substancja, która rozpuszcza inne substancje, a substancja rozpuszczana to ta, która się rozpuszcza.
Stężenie roztworu określa ilość substancji rozpuszczonej w danej objętości roztworu. Najczęściej spotykane jednostki stężenia to:
- Stężenie molowe (mol/L): liczba moli substancji rozpuszczonej w 1 litrze roztworu.
- Stężenie procentowe (%): masa substancji rozpuszczonej w 100 gramach roztworu.
Dysocjacja Jonowa
Dysocjacja jonowa to proces rozpadu związku jonowego na jony w roztworze wodnym. Jest to kluczowy proces w wielu reakcjach, ponieważ jony stają się nośnikami ładunku i mogą brać udział w reakcjach. Na przykład, chlorek sodu (NaCl) dysocjuje na jony sodu (Na+) i jony chlorkowe (Cl-):
NaCl (s) → Na+ (aq) + Cl- (aq)
Pamiętajcie, że nie wszystkie związki dysocjują w takim samym stopniu. Mocne elektrolity dysocjują całkowicie, a słabe elektrolity tylko częściowo.
Typy Reakcji w Roztworach Wodnych
Teraz, kiedy mamy solidne podstawy, możemy przejść do omówienia różnych typów reakcji zachodzących w roztworach wodnych.
Reakcje Strącania
Reakcje strącania zachodzą, gdy zmieszamy dwa roztwory zawierające jony, które tworzą związek nierozpuszczalny w wodzie, czyli osad. Aby przewidzieć, czy reakcja strącania zajdzie, korzystamy z tabeli rozpuszczalności. Tabela ta informuje nas, które związki są rozpuszczalne, a które nierozpuszczalne (lub słabo rozpuszczalne) w wodzie.
Na przykład, zmieszanie roztworu azotanu srebra (AgNO3) z roztworem chlorku sodu (NaCl) prowadzi do powstania osadu chlorku srebra (AgCl):
AgNO3 (aq) + NaCl (aq) → AgCl (s) + NaNO3 (aq)
Równanie jonowe pełne pokazuje wszystkie jony obecne w roztworze. W powyższym przykładzie:
Ag+ (aq) + NO3- (aq) + Na+ (aq) + Cl- (aq) → AgCl (s) + Na+ (aq) + NO3- (aq)
Równanie jonowe skrócone pokazuje tylko jony, które biorą udział w tworzeniu osadu. Jony, które nie ulegają zmianie (czyli jony widzowe), są pomijane:
Ag+ (aq) + Cl- (aq) → AgCl (s)
Reakcje Kwasowo-Zasadowe (Neutralizacja)
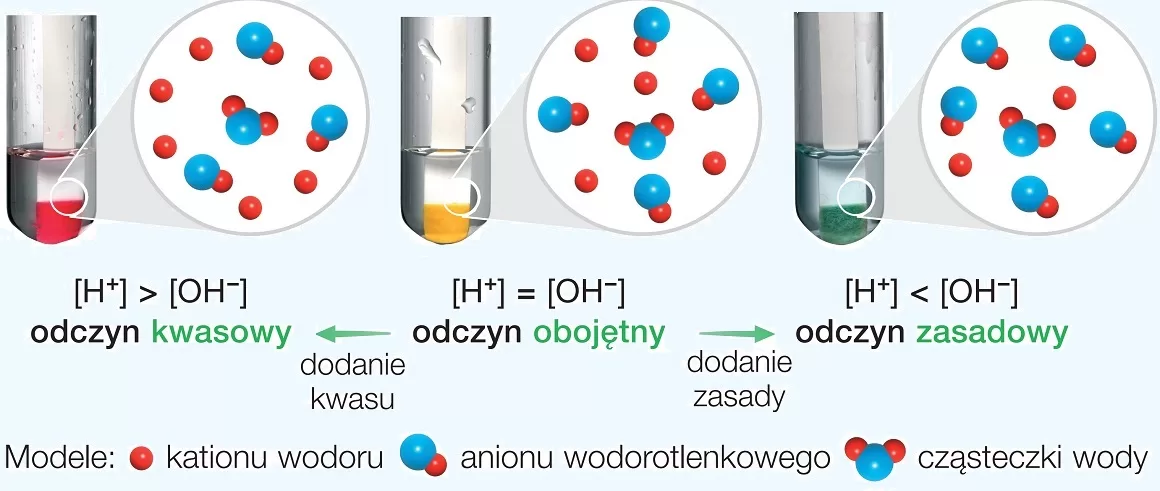
Reakcje kwasowo-zasadowe, zwane również reakcjami neutralizacji, zachodzą między kwasem i zasadą. W wyniku tej reakcji powstaje sól i woda. Kwasy to substancje, które w roztworze wodnym zwiększają stężenie jonów wodorowych (H+), a zasady zwiększają stężenie jonów wodorotlenkowych (OH-).
Mocne kwasy i zasady dysocjują całkowicie w wodzie, a słabe tylko częściowo. Przykładem mocnego kwasu jest kwas solny (HCl), a mocnej zasady – wodorotlenek sodu (NaOH).
Reakcja neutralizacji między mocnym kwasem a mocną zasadą wygląda następująco:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
Równanie jonowe skrócone dla tej reakcji to:
H+ (aq) + OH- (aq) → H2O (l)
Miareczkowanie to technika laboratoryjna, która pozwala na określenie stężenia kwasu lub zasady za pomocą reakcji neutralizacji. Używamy do tego wskaźników kwasowo-zasadowych, które zmieniają kolor w zależności od pH roztworu.
Reakcje Redoks
Reakcje redoks (reakcje utleniania-redukcji) to reakcje, w których następuje zmiana stopni utlenienia atomów. Utlenianie to proces, w którym atom traci elektrony, a jego stopień utlenienia wzrasta. Redukcja to proces, w którym atom zyskuje elektrony, a jego stopień utlenienia maleje.
Substancja, która utlenia inną substancję, nazywana jest utleniaczem (sama się redukuje). Substancja, która redukuje inną substancję, nazywana jest reduktorem (sama się utlenia).
Przykładowa reakcja redoks:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
W tej reakcji cynk (Zn) utlenia się do jonu cynku (Zn2+), oddając dwa elektrony, a jon miedzi (Cu2+) redukuje się do miedzi (Cu), przyjmując te elektrony.
Aby zbilansować równania redoks, często stosuje się metodę połówkowych reakcji. Polega ona na rozdzieleniu reakcji na dwie połówkowe reakcje: utleniania i redukcji, zbilansowaniu każdej z nich osobno, a następnie połączeniu ich w jedną zbilansowaną reakcję.
Czynniki Wpływające na Szybkość Reakcji
Na szybkość reakcji chemicznych zachodzących w roztworach wodnych wpływa kilka czynników:
- Stężenie reagentów: Zwiększenie stężenia reagentów zwykle przyspiesza reakcję.
- Temperatura: Zwiększenie temperatury zwykle przyspiesza reakcję.
- Katalizator: Katalizator to substancja, która przyspiesza reakcję, nie zużywając się w jej trakcie.
- Powierzchnia kontaktu: W przypadku reakcji zachodzących na powierzchni ciała stałego, zwiększenie powierzchni kontaktu przyspiesza reakcję.
Podsumowanie i Wskazówki
Gratulacje! Przeszliśmy przez najważniejsze zagadnienia dotyczące reakcji w roztworach wodnych. Pamiętajcie o kilku kluczowych punktach:
- Zrozumienie pojęć: roztwór wodny, dysocjacja jonowa, stężenie.
- Znajomość typów reakcji: strącanie, kwasowo-zasadowe, redoks.
- Umiejętność pisania równań jonowych pełnych i skróconych.
- Znajomość czynników wpływających na szybkość reakcji.
Wskazówki przed sprawdzianem:
- Przejrzyjcie notatki z lekcji i rozwiążcie zadania z podręcznika.
- Wykonajcie dodatkowe zadania, aby utrwalić wiedzę.
- Sprawdźcie tablicę rozpuszczalności i nauczcie się z niej korzystać.
- Pamiętajcie o jednostkach!
- Przede wszystkim, zachowajcie spokój i wiarę w siebie!
Powodzenia na sprawdzianie! Pamiętajcie, że chemia to fascynująca dziedzina, a zrozumienie tych reakcji otworzy Wam drzwi do dalszej nauki. Trzymam kciuki!