Reakcje Otrzymywania Wodorotlenku Sodu

Hej Studencie! Przygotowujesz się do egzaminu z chemii, a konkretnie z reakcji otrzymywania wodorotlenku sodu (NaOH)? Świetnie trafiłeś! Ten przewodnik pomoże Ci zrozumieć kluczowe metody, zasady i niuanse związane z tym ważnym związkiem chemicznym. Nie martw się, krok po kroku przejdziemy przez wszystkie istotne informacje.
Wprowadzenie do Wodorotlenku Sodu (NaOH)
Zanim zagłębimy się w metody otrzymywania, upewnijmy się, że rozumiemy, czym jest wodorotlenek sodu. To nieorganiczny związek chemiczny, silna zasada, znana również jako soda kaustyczna lub ług sodowy. Ma postać białego, higroskopijnego ciała stałego. Rozpuszczalny w wodzie, proces ten jest egzotermiczny (wydziela ciepło), tworząc silnie zasadowy roztwór. Jest szeroko stosowany w przemyśle, m.in. do produkcji papieru, mydła, detergentów, a także w procesach chemicznych i oczyszczaniu ścieków.
Metody Otrzymywania Wodorotlenku Sodu
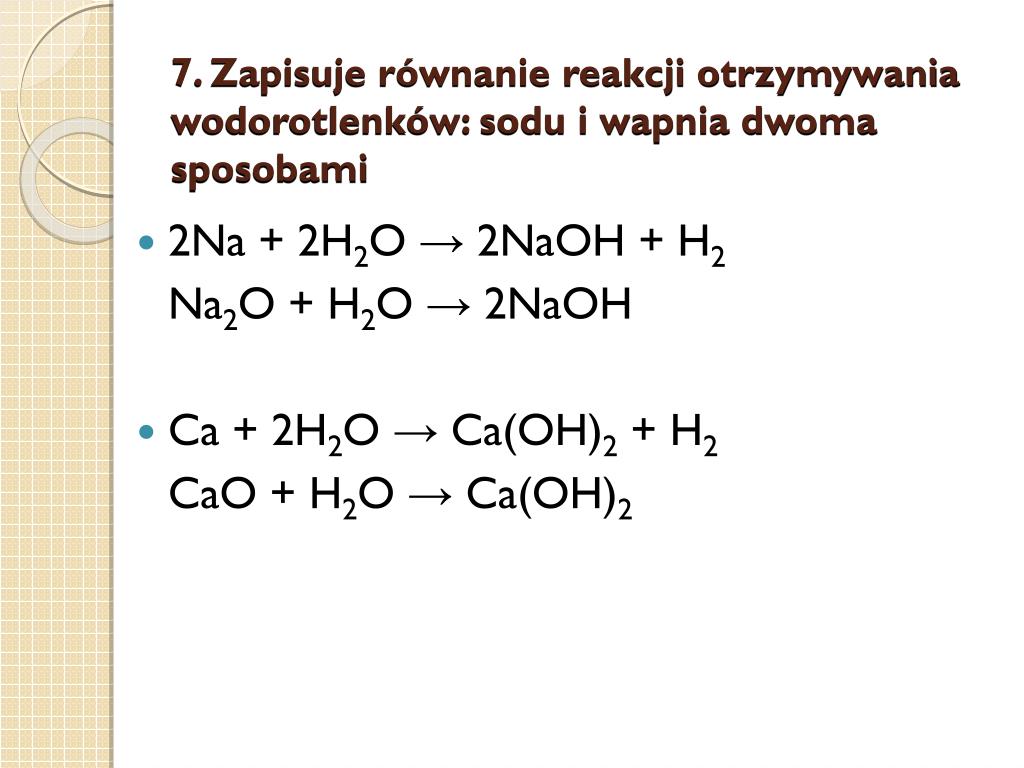
Istnieją głównie dwie przemysłowe metody otrzymywania wodorotlenku sodu: proces elektrolizy chlorku sodu (NaCl) i metoda chemiczna oparta na reakcji węglanu sodu z wapnem gaszonym.
1. Elektroliza Chlorku Sodu (Metoda Elektrolityczna)
To zdecydowanie najczęściej stosowana metoda. Polega na elektrolizie wodnego roztworu chlorku sodu (solanki). Elektroliza to rozkład związku chemicznego pod wpływem prądu elektrycznego.
Istnieją trzy główne warianty tego procesu, różniące się konstrukcją elektrolizera i materiałami używanymi do budowy elektrod:
a) Metoda Merkuryalna (Proces rtęciowy)
To historycznie najstarsza metoda, ale obecnie rzadziej stosowana ze względu na problemy ekologiczne związane z użyciem rtęci. W elektrolizerze używa się katody rtęciowej. Na katodzie powstaje amalgamat sodu (stop sodu z rtęcią), który następnie reaguje z wodą, tworząc wodorotlenek sodu i wodór, a rtęć wraca do obiegu:
Katoda: Na+(aq) + e- → Na(Hg) (amalgamat sodu)
Reakcja amalgamat: 2Na(Hg) + 2H2O → 2NaOH + H2 + Hg
Anoda: 2Cl-(aq) → Cl2(g) + 2e-
Zalety: Otrzymywany NaOH jest bardzo czysty.
Wady: Użycie rtęci stwarza zagrożenie dla środowiska. Wysokie koszty budowy i eksploatacji.
b) Metoda Membranowa
Jest to najnowocześniejsza i najbardziej przyjazna dla środowiska metoda. W elektrolizerze znajduje się membrana jonowymienna, która przepuszcza tylko jony sodu (Na+), zapobiegając mieszaniu się roztworu anodowego (chlorek sodu) z roztworem katodowym (wodorotlenek sodu). Na anodzie wydziela się chlor, a na katodzie wodór:
Katoda: 2H2O + 2e- → H2(g) + 2OH-
Anoda: 2Cl-(aq) → Cl2(g) + 2e-
Jony sodu (Na+) przechodzą przez membranę i łączą się z jonami wodorotlenkowymi (OH-) tworząc NaOH. Membrany są wykonane z polimerów fluorowanych z grupami sulfonowymi (np. Nafion).
Zalety: Brak zanieczyszczeń rtęcią, niższe zużycie energii niż w metodzie rtęciowej.
Wady: Wyższe koszty początkowe związane z zakupem membran.
c) Metoda Diaphragmowa (Proces przeponowy)
W tej metodzie, elektrolizer jest podzielony przeponą azbestową (obecnie stosuje się zamienniki, np. z włókien ceramicznych lub polimerów). Przepona pozwala na przepływ roztworu, ale ogranicza mieszanie się roztworów anodowego i katodowego. Powstający roztwór NaOH jest zanieczyszczony chlorkiem sodu i wymaga dalszego zagęszczania przez odparowanie wody.
Katoda: 2H2O + 2e- → H2(g) + 2OH-
Anoda: 2Cl-(aq) → Cl2(g) + 2e-
Zalety: Niższy koszt inwestycyjny niż metoda membranowa.
Wady: Powstający NaOH jest zanieczyszczony NaCl, wymaga zagęszczania, przepona z azbestu jest szkodliwa.
2. Metoda Chemiczna (Metoda z Użyciem Wapna Gaszonego)
Ta metoda jest historyczna i obecnie mniej powszechna niż elektroliza, ale warto o niej wiedzieć. Polega na reakcji węglanu sodu (Na2CO3), zwanego również sodą kalcynowaną, z wodorotlenkiem wapnia (Ca(OH)2), czyli wapnem gaszonym:
Na2CO3(aq) + Ca(OH)2(aq) → 2NaOH(aq) + CaCO3(s)
Węglan wapnia (CaCO3) wytrąca się w postaci osadu, a roztwór wodorotlenku sodu można oddzielić i zagęścić.
Zalety: Prosta reakcja.
Wady: Otrzymywany NaOH jest zanieczyszczony, wymaga oczyszczania. Metoda mniej ekonomiczna niż elektroliza.
Podsumowanie
Brawo! Dotarliśmy do końca! Oto kluczowe punkty dotyczące otrzymywania wodorotlenku sodu:
- Wodorotlenek sodu (NaOH) to silna zasada o szerokim zastosowaniu w przemyśle.
- Główną metodą przemysłową jest elektroliza chlorku sodu (NaCl).
- Wyróżniamy trzy warianty elektrolizy: merkuryalną (z użyciem rtęci, rzadko stosowana), membranową (najnowocześniejsza i ekologiczna) i diaphragmową (z przeponą).
- Metoda chemiczna polega na reakcji węglanu sodu (Na2CO3) z wapnem gaszonym (Ca(OH)2).
Pamiętaj, żeby dobrze zrozumieć reakcje chemiczne zachodzące w poszczególnych metodach i znać zalety oraz wady każdej z nich. Powodzenia na egzaminie! Wierzę w Ciebie!