Reakcje Otrzymywania Wodorotlenków

Wodorotlenki, związki o wzorze ogólnym MOH, gdzie M to metal, a OH to grupa wodorotlenowa, stanowią istotną grupę związków chemicznych. Znajdują one szerokie zastosowanie w przemyśle, laboratoriach oraz w życiu codziennym. Zrozumienie metod ich otrzymywania jest kluczowe dla chemików, inżynierów i każdego, kto interesuje się chemią. W tym artykule omówimy główne reakcje prowadzące do syntezy wodorotlenków, zwracając uwagę na czynniki wpływające na przebieg tych reakcji i ich praktyczne zastosowania.
Metody Otrzymywania Wodorotlenków
Reakcja Metali z Wodą
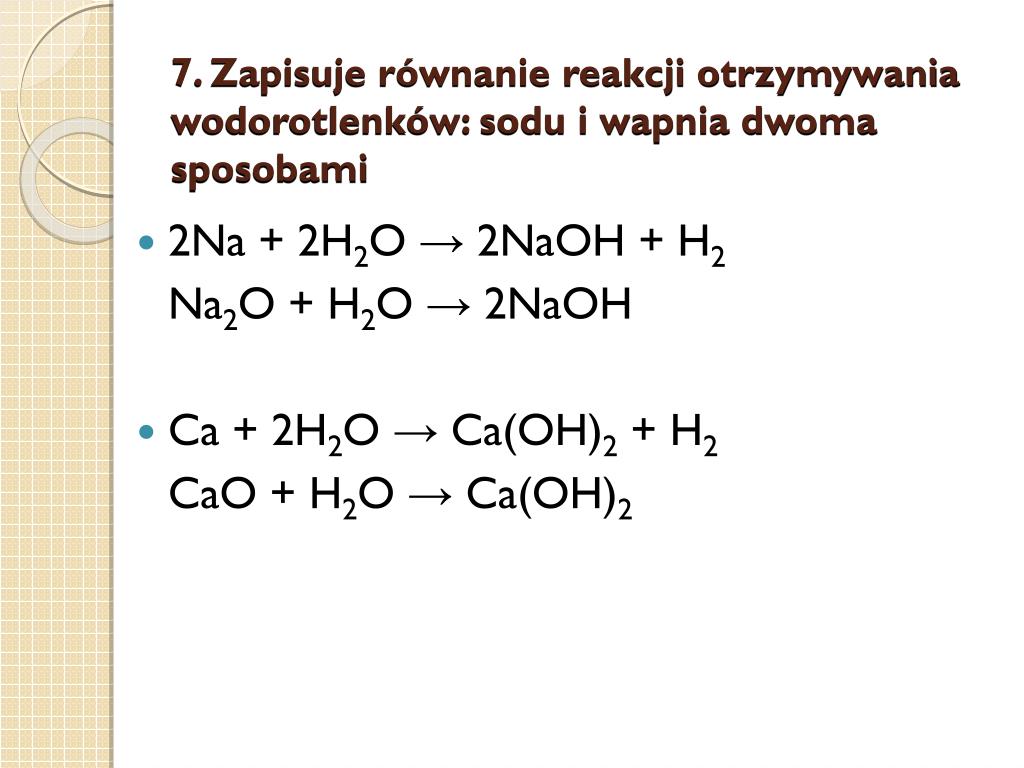
Jedną z najprostszych metod otrzymywania wodorotlenków jest reakcja aktywnych metali z wodą. Metale alkaliczne (Li, Na, K, Rb, Cs) i metale ziem alkalicznych (Ca, Sr, Ba), reagują z wodą, tworząc wodorotlenki i wydzielając wodór.
Przykładowo, reakcja sodu (Na) z wodą wygląda następująco:
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
Reakcja ta jest egzotermiczna, co oznacza, że wydziela ciepło. W przypadku metali alkalicznych, takich jak potas (K) czy cez (Cs), reakcja jest bardzo gwałtowna i może prowadzić do zapłonu wydzielającego się wodoru.
Reakcja wapnia (Ca) z wodą:
Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)
Reakcja ta jest mniej gwałtowna niż w przypadku metali alkalicznych, ale nadal prowadzi do powstania wodorotlenku wapnia, znanego również jako woda wapienna.
Ważne aspekty tej metody:
- Aktywność metalu: Im bardziej aktywny metal, tym gwałtowniejsza reakcja.
- Temperatura: Podwyższenie temperatury zazwyczaj przyspiesza reakcję.
- Stężenie: W przypadku niektórych metali reakcja zachodzi tylko z czystą wodą.
Reakcja Tlenków Metali z Wodą
Tlenki metali alkalicznych i ziem alkalicznych reagują z wodą, tworząc odpowiednie wodorotlenki.
Na przykład, reakcja tlenku sodu (Na2O) z wodą:
Na2O(s) + H2O(l) → 2NaOH(aq)
Podobnie, reakcja tlenku wapnia (CaO) z wodą:
CaO(s) + H2O(l) → Ca(OH)2(aq)
Reakcja tlenku wapnia z wodą jest wykorzystywana na dużą skalę do produkcji wapna gaszonego, które znajduje zastosowanie w budownictwie i rolnictwie.
Ważne aspekty tej metody:
- Rozpuszczalność tlenku: Tlenki metali alkalicznych są zazwyczaj dobrze rozpuszczalne w wodzie, co ułatwia reakcję. Tlenki metali ziem alkalicznych są mniej rozpuszczalne, co wpływa na szybkość reakcji.
- Temperatura: Wzrost temperatury może nieznacznie zwiększyć rozpuszczalność tlenków i przyspieszyć reakcję.
Elektroliza Roztworów Soli
Elektroliza roztworów soli metali alkalicznych i ziem alkalicznych prowadzi do powstania wodorotlenków na katodzie. Podczas elektrolizy woda ulega redukcji, tworząc jony wodorotlenowe i gazowy wodór.
Przykładowo, elektroliza roztworu chlorku sodu (NaCl):
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g)
W tej reakcji wodorotlenek sodu powstaje w pobliżu katody, a chlor gazowy wydziela się na anodzie. Elektroliza chlorku sodu jest przemysłową metodą produkcji chloru, wodoru i wodorotlenku sodu.
Ważne aspekty tej metody:
- Rodzaj soli: Elektroliza soli metali alkalicznych i ziem alkalicznych prowadzi do powstania wodorotlenków.
- Materiał elektrod: Wybór odpowiednich elektrod jest kluczowy, aby uniknąć niepożądanych reakcji.
- Stężenie: Odpowiednie stężenie roztworu soli jest istotne dla efektywnego przebiegu elektrolizy.
Reakcja Soli z Wodorotlenkami
Wodorotlenki można również otrzymać poprzez reakcję rozpuszczalnych soli z innymi wodorotlenkami. Warunkiem zajścia reakcji jest powstanie osadu – nierozpuszczalnego wodorotlenku.
Przykładem jest reakcja chlorku żelaza(III) (FeCl3) z wodorotlenkiem sodu (NaOH):
FeCl3(aq) + 3NaOH(aq) → Fe(OH)3(s) + 3NaCl(aq)
W tej reakcji powstaje osad wodorotlenku żelaza(III), który jest nierozpuszczalny w wodzie. Reakcje te są często wykorzystywane w analizie jakościowej do wykrywania obecności jonów metali.
Inny przykład, reakcja siarczanu miedzi(II) (CuSO4) z wodorotlenkiem potasu (KOH):
CuSO4(aq) + 2KOH(aq) → Cu(OH)2(s) + K2SO4(aq)
Powstaje osad wodorotlenku miedzi(II), o charakterystycznym niebieskim kolorze.
Ważne aspekty tej metody:
- Rozpuszczalność soli: Sól musi być rozpuszczalna w wodzie, aby reakcja mogła zajść.
- Nierozpuszczalność wodorotlenku: Powstający wodorotlenek musi być nierozpuszczalny w wodzie, aby reakcja zaszła do końca.
- Stężenie reagentów: Odpowiednie stężenia reagentów są istotne dla efektywnego wytrącania osadu.
Przykłady Zastosowań Wodorotlenków
Wodorotlenki znajdują szerokie zastosowanie w różnych dziedzinach. Wodorotlenek sodu (NaOH) jest używany w przemyśle papierniczym, tekstylnym, chemicznym (produkcja mydeł, detergentów), a także w procesach rafinacji ropy naftowej. Wodorotlenek wapnia (Ca(OH)2) jest stosowany w budownictwie (produkcja zapraw murarskich), rolnictwie (regulacja pH gleby) i w oczyszczaniu ścieków. Wodorotlenek magnezu (Mg(OH)2) jest używany w medycynie jako środek zobojętniający kwas żołądkowy.
Dane dotyczące produkcji wodorotlenku sodu wskazują na ciągły wzrost zapotrzebowania, co świadczy o jego znaczeniu w przemyśle. Roczna produkcja NaOH na świecie sięga dziesiątek milionów ton.
Bezpieczeństwo Pracy z Wodorotlenkami
Należy pamiętać, że wodorotlenki, zwłaszcza te silnie zasadowe, są substancjami żrącymi. Kontakt ze skórą, oczami lub drogami oddechowymi może powodować poważne oparzenia. Podczas pracy z wodorotlenkami należy stosować odpowiednie środki ochrony osobistej, takie jak okulary ochronne, rękawice i fartuch. W przypadku kontaktu ze skórą należy natychmiast spłukać dużą ilością wody. Należy również unikać wdychania pyłów lub par wodorotlenków.
Podsumowanie
Otrzymywanie wodorotlenków jest możliwe różnymi metodami, z których każda ma swoje zalety i wady. Wybór metody zależy od rodzaju wodorotlenku, skali produkcji oraz dostępności surowców. Znajomość tych metod jest kluczowa dla chemików, inżynierów i wszystkich, którzy zajmują się syntezą i zastosowaniem tych ważnych związków chemicznych.
Zachęcam do dalszego zgłębiania wiedzy na temat wodorotlenków i ich zastosowań, ponieważ ich rola w różnych dziedzinach nauki i przemysłu jest niezaprzeczalna. Eksperymentujcie (z zachowaniem zasad bezpieczeństwa!) i odkrywajcie fascynujący świat chemii!