Reakcja Otrzymywania Wodorotlenków
Czy kiedykolwiek zastanawiałeś się, jak powstają wodorotlenki? Te wszechstronne związki, obecne w wielu aspektach naszego życia, od środków czystości po farmaceutyki, kryją w sobie fascynującą historię reakcji chemicznych. Ten artykuł ma na celu przybliżenie procesu otrzymywania wodorotlenków, wyjaśniając mechanizmy, czynniki wpływające na reakcję i praktyczne zastosowania tej wiedzy. Adresowany jest do studentów chemii, pasjonatów nauki oraz każdego, kto chce lepiej zrozumieć świat chemii wokół nas.
Wodorotlenki – Co to Takiego?
Zanim przejdziemy do metod otrzymywania, ważne jest, aby zrozumieć, czym właściwie są wodorotlenki. Wodorotlenki to związki chemiczne zawierające grupę hydroksylową (-OH) związaną z metalem lub grupą amonową (NH4+). Generalny wzór wodorotlenków metali to M(OH)n, gdzie M to metal, a n to jego wartościowość. Charakteryzują się one zasadowym odczynem w roztworach wodnych i często wykazują właściwości korozyjne. Do najpopularniejszych wodorotlenków należą wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH) oraz wodorotlenek wapnia (Ca(OH)2).
Metody Otrzymywania Wodorotlenków
Istnieje kilka głównych metod otrzymywania wodorotlenków, które różnią się w zależności od metalu i pożądanej czystości produktu. Przyjrzyjmy się im bliżej:
1. Reakcja Metali z Wodą
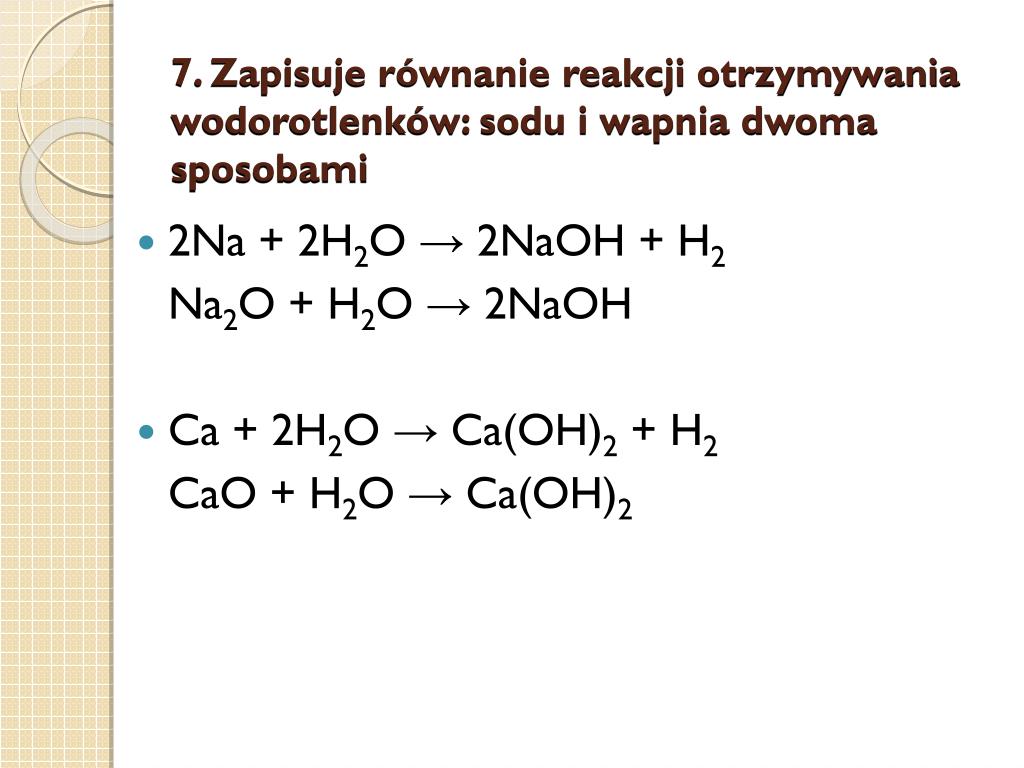
Najprostszą metodą otrzymywania wodorotlenków jest reakcja metali aktywnych (głównie grupy 1 i 2 układu okresowego) z wodą. Metale te charakteryzują się dużą elektrododatniością, co oznacza, że łatwo oddają elektrony w reakcji z wodą. Ogólny schemat reakcji wygląda następująco:
2M + 2H2O → 2MOH + H2
Gdzie M to metal alkaliczny (np. lit, sód, potas) lub metal ziem alkalicznych (np. wapń, stront, bar). Reakcja ta jest zazwyczaj egzotermiczna, a w przypadku metali alkalicznych bardzo gwałtowna. Przykładem jest reakcja sodu z wodą:
2Na + 2H2O → 2NaOH + H2
Powstały wodorotlenek sodu (NaOH) rozpuszcza się w wodzie, tworząc silnie zasadowy roztwór. Ważne jest, aby przeprowadzać tę reakcję z zachowaniem ostrożności, ponieważ wydzielający się wodór jest łatwopalny.
Zalety tej metody: Prostota, dostępność reagentów.
Wady tej metody: Ograniczona do metali aktywnych, reakcja może być zbyt gwałtowna.
2. Reakcja Tlenków Metali z Wodą
Inną powszechną metodą jest reakcja tlenków metali z wodą. Metoda ta jest szczególnie przydatna do otrzymywania wodorotlenków metali ziem alkalicznych. Ogólny schemat reakcji:
MO + H2O → M(OH)2
Gdzie MO to tlenek metalu (np. tlenek wapnia, tlenek baru). Przykładem jest reakcja tlenku wapnia (CaO) z wodą, zwana gaszeniem wapna:
CaO + H2O → Ca(OH)2
Powstały wodorotlenek wapnia (Ca(OH)2) jest znany jako wapno gaszone i jest szeroko stosowany w budownictwie. Reakcja ta również jest egzotermiczna, ale przebiega mniej gwałtownie niż reakcja metali z wodą.
Zalety tej metody: Bezpieczniejsza niż reakcja metali z wodą, stosowana do otrzymywania wodorotlenków metali ziem alkalicznych.
Wady tej metody: Ograniczona do tlenków metali, reakcja może być powolna w przypadku niektórych tlenków.
3. Reakcja Soli Metali z Zasadami
Kolejną metodą jest reakcja soli metali z mocnymi zasadami, takimi jak wodorotlenek sodu (NaOH) lub wodorotlenek potasu (KOH). Ta metoda jest stosowana do otrzymywania wodorotlenków metali, których tlenki nie reagują z wodą lub reagują bardzo powoli. Ogólny schemat reakcji:
MXn + nNaOH → M(OH)n + nNaX
Gdzie MXn to sól metalu (np. chlorek żelaza(III), siarczan miedzi(II)), a NaX to sól sodu. Przykładem jest reakcja chlorku żelaza(III) z wodorotlenkiem sodu:
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Powstały wodorotlenek żelaza(III) (Fe(OH)3) wytrąca się z roztworu w postaci osadu. Ważne jest, aby dobrać odpowiednie stężenia reagentów i kontrolować pH roztworu, aby zapewnić efektywne wytrącanie wodorotlenku.
Zalety tej metody: Uniwersalna, stosowana do otrzymywania wodorotlenków różnych metali.
Wady tej metody: Wymaga użycia mocnych zasad, generuje sól jako produkt uboczny.
4. Elektroliza Wodnych Roztworów Soli
Elektroliza to proces, w którym substancja chemiczna ulega rozkładowi pod wpływem przepływu prądu elektrycznego. Elektroliza wodnych roztworów soli, takich jak chlorek sodu (NaCl), jest stosowana do przemysłowego otrzymywania wodorotlenku sodu (NaOH), chloru (Cl2) i wodoru (H2). Proces ten odbywa się w specjalnych urządzeniach zwanych elektrolizerami. Ogólny schemat reakcji:
2NaCl + 2H2O → 2NaOH + Cl2 + H2
Podczas elektrolizy jony chlorkowe (Cl-) utleniają się na anodzie, tworząc chlor, a woda redukuje się na katodzie, tworząc wodorotlenek sodu i wodór. Membrana jonowymienna w elektrolizerze zapobiega mieszaniu się produktów i zapewnia wysoką czystość otrzymywanego wodorotlenku sodu.
Zalety tej metody: Przemysłowa produkcja wodorotlenku sodu, możliwość otrzymywania innych cennych produktów (chlor, wodór).
Wady tej metody: Energochłonna, wymaga specjalistycznego sprzętu.
Czynniki Wpływające na Reakcję Otrzymywania Wodorotlenków
Na przebieg i efektywność reakcji otrzymywania wodorotlenków wpływa szereg czynników. Do najważniejszych należą:
- Aktywność Metalu: Metale bardziej aktywne łatwiej reagują z wodą, tworząc wodorotlenki.
- Temperatura: Wzrost temperatury zazwyczaj przyspiesza reakcję, ale może również prowadzić do rozkładu wodorotlenku.
- Stężenie Reagentów: Zwiększenie stężenia reagentów zazwyczaj przyspiesza reakcję, ale może również prowadzić do wytrącania się osadów.
- pH Roztworu: pH roztworu ma wpływ na rozpuszczalność i stabilność wodorotlenków.
- Obecność Katalizatorów: Niektóre reakcje wymagają obecności katalizatorów, aby przebiegały z odpowiednią szybkością.
Zastosowania Wodorotlenków
Wodorotlenki znajdują szerokie zastosowanie w różnych dziedzinach. Oto kilka przykładów:
- Przemysł Chemiczny: Produkcja mydeł, detergentów, barwników, papieru i wielu innych produktów.
- Oczyszczanie Wody: Regulacja pH wody, usuwanie zanieczyszczeń.
- Budownictwo: Produkcja zapraw murarskich, tynków i innych materiałów budowlanych.
- Farmacja: Składnik leków zobojętniających kwas żołądkowy.
- Przemysł Spożywczy: Przetwarzanie żywności, np. produkcja kakao.
Podsumowanie
Otrzymywanie wodorotlenków to proces, który można zrealizować na wiele sposobów, wykorzystując różne reakcje chemiczne. Wybór metody zależy od rodzaju wodorotlenku, skali produkcji i dostępności reagentów. Zrozumienie mechanizmów reakcji i czynników wpływających na ich przebieg pozwala na optymalizację procesu i otrzymanie produktu o pożądanych właściwościach. Wiedza na temat wodorotlenków jest kluczowa dla studentów chemii, chemików pracujących w przemyśle oraz wszystkich, którzy chcą lepiej rozumieć świat chemii.
Mam nadzieję, że ten artykuł przybliżył Ci temat otrzymywania wodorotlenków i zainspirował do dalszego zgłębiania wiedzy z zakresu chemii. Pamiętaj, że chemia to fascynująca dziedzina, która pozwala zrozumieć i kształtować świat wokół nas.








