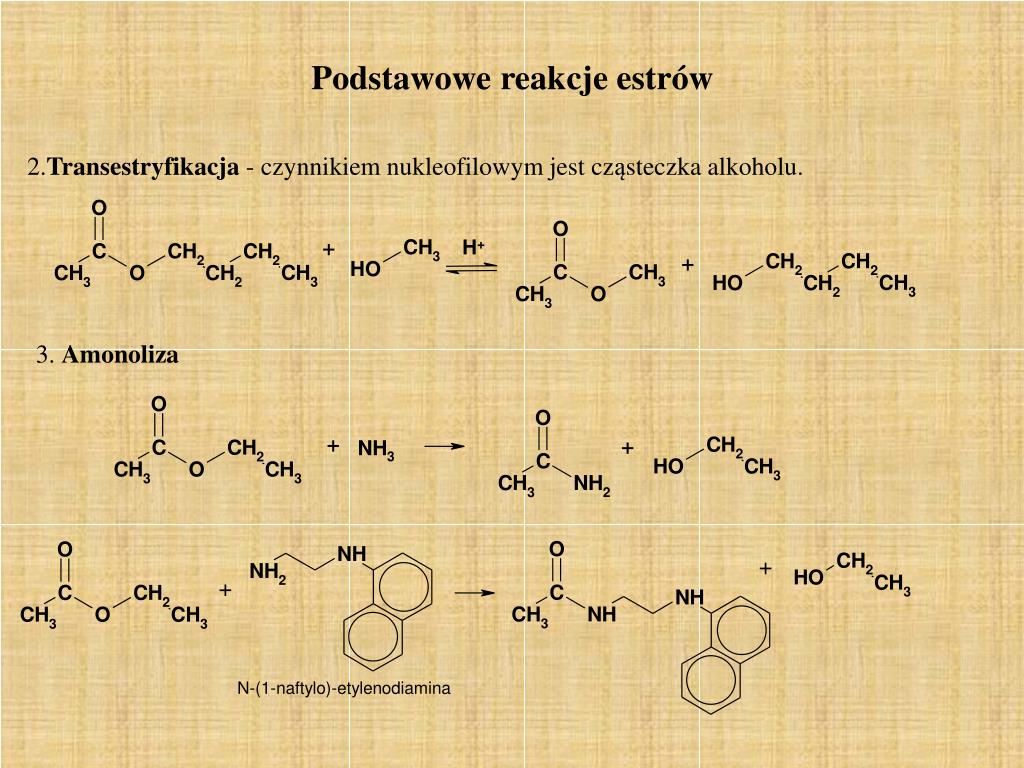
Reakcja Estryfikacji Przykłady

Czy kiedykolwiek zastanawiałeś się, jak powstają słodkie zapachy owoców lub smakowite aromaty wielu kosmetyków? Kluczem do tych zmysłowych doświadczeń jest często estryfikacja, reakcja chemiczna, która łączy kwasy karboksylowe z alkoholami, tworząc estry. W tym artykule zgłębimy tajniki estryfikacji, wyjaśniając jej mechanizm, prezentując konkretne przykłady i pokazując, jak ta reakcja wpływa na nasze codzienne życie.
Czym jest Estryfikacja? Definicja i Podstawy
Estryfikacja to reakcja chemiczna, w której kwas karboksylowy reaguje z alkoholem, prowadząc do powstania estru i wody. Jest to reakcja odwracalna, co oznacza, że może przebiegać w obie strony, aż do osiągnięcia stanu równowagi. Ogólny schemat reakcji wygląda następująco:
Kwas karboksylowy + Alkohol ⇌ Ester + Woda
Kluczowe pojęcia, które warto zapamiętać:
- Kwas karboksylowy: Związek organiczny zawierający grupę karboksylową (-COOH). Przykłady: kwas octowy (CH3COOH), kwas mrówkowy (HCOOH).
- Alkohol: Związek organiczny zawierający grupę hydroksylową (-OH) związaną z atomem węgla nienależącym do pierścienia aromatycznego. Przykłady: etanol (C2H5OH), metanol (CH3OH).
- Ester: Związek organiczny, który powstaje w wyniku zastąpienia atomu wodoru w grupie karboksylowej kwasu grupą alkilową lub arylową pochodzącą z alkoholu. Estry często charakteryzują się przyjemnym zapachem.
Reakcja estryfikacji zazwyczaj wymaga obecności katalizatora, najczęściej kwasu siarkowego (H2SO4), który przyspiesza reakcję poprzez protonowanie grupy karbonylowej kwasu karboksylowego, zwiększając jej podatność na atak nukleofilowy przez alkohol.
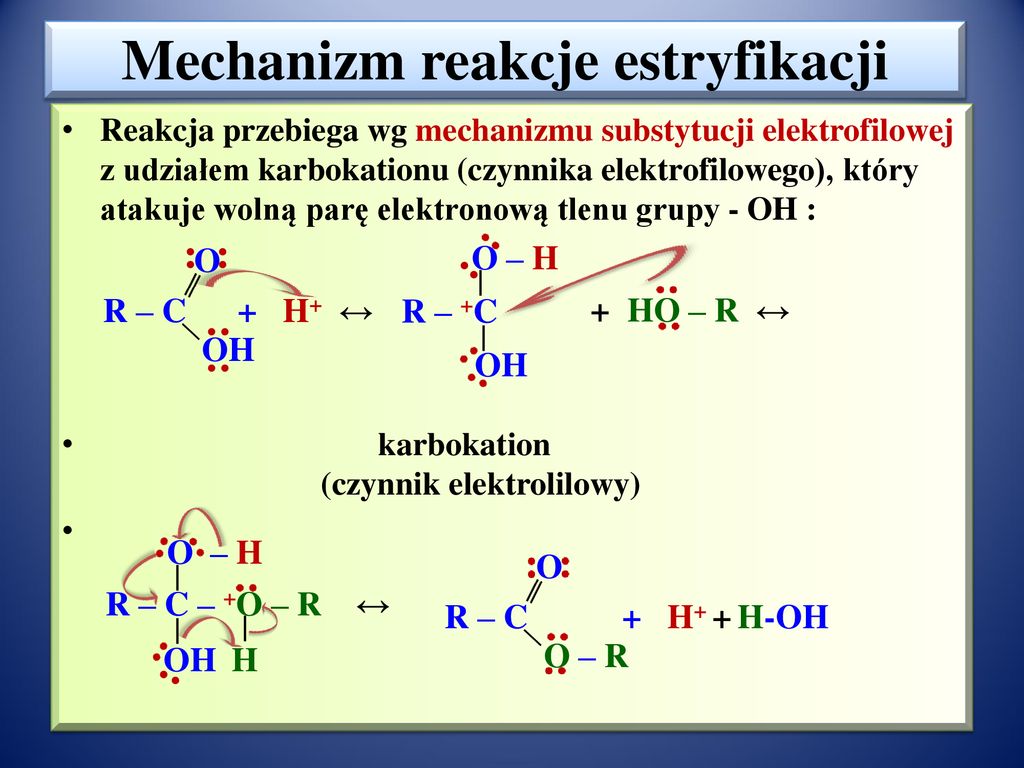
Mechanizm Reakcji Estryfikacji
Dokładne zrozumienie mechanizmu reakcji estryfikacji pozwala przewidywać jej przebieg i kontrolować jej efektywność. Uproszczony mechanizm, katalizowany kwasem, składa się z następujących etapów:
- Protonowanie grupy karbonylowej kwasu karboksylowego: Katalizator kwasowy (np. H2SO4) oddaje proton do atomu tlenu w grupie karbonylowej (C=O) kwasu karboksylowego. Powoduje to zwiększenie elektrofilowości atomu węgla karbonylowego.
- Atak nukleofilowy alkoholu: Atom tlenu w grupie hydroksylowej (-OH) alkoholu atakuje elektrofilowy atom węgla karbonylowy kwasu karboksylowego. Powstaje nietrwały tetraedryczny związek pośredni.
- Przeniesienie protonu: Proton jest przenoszony z zaatakowanej grupy hydroksylowej alkoholu na grupę hydroksylową związaną z węglem karbonylowym.
- Odlączeniem wody: Grupa hydroksylowa, która została sprotonowana, odłącza się w postaci cząsteczki wody (H2O). Powstaje protonowany ester.
- Deprotonowanie: Proton jest odłączany od protonowanego estru, regenerując katalizator kwasowy i tworząc końcowy produkt – ester.
Warto pamiętać, że reakcja estryfikacji jest reakcją równowagi. Oznacza to, że po pewnym czasie szybkość tworzenia estru staje się równa szybkości jego hydrolizy (rozkładu na kwas karboksylowy i alkohol). Aby przesunąć równowagę reakcji w stronę tworzenia estru, stosuje się kilka metod:
- Użycie nadmiaru jednego z substratów (kwasu karboksylowego lub alkoholu): Zgodnie z zasadą Le Chateliera-Brauna, zwiększenie stężenia jednego z substratów przesunie równowagę w stronę tworzenia produktów.
- Usuwanie wody z mieszaniny reakcyjnej: Usuwanie jednego z produktów (wody) również przesunie równowagę w stronę tworzenia estru. Można to osiągnąć np. poprzez użycie substancji higroskopijnych lub destylację azeotropową.
Przykłady Reakcji Estryfikacji
Reakcja estryfikacji ma szerokie zastosowanie w wielu dziedzinach. Poniżej przedstawiamy kilka konkretnych przykładów:
Estryfikacja Kwasu Octowego
Kwas octowy (CH3COOH) reaguje z etanolem (C2H5OH) w obecności kwasu siarkowego jako katalizatora, tworząc octan etylu (CH3COOC2H5) i wodę. Octan etylu jest rozpuszczalnikiem stosowanym w farbach, lakierach i klejach. Ma również przyjemny, owocowy zapach.
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
Estryfikacja Kwasu Salicylowego
Kwas salicylowy reaguje z bezwodnikiem octowym, tworząc kwas acetylosalicylowy (aspirynę) i kwas octowy. Jest to przykład estryfikacji, w której zamiast alkoholu używa się bezwodnika kwasowego. Aspiryna jest powszechnie stosowanym lekiem przeciwbólowym, przeciwgorączkowym i przeciwzapalnym.
C7H6O3 + (CH3CO)2O → C9H8O4 + CH3COOH
Powstawanie Tłuszczów (Triglicerydów)
Tłuszcze, czyli triglicerydy, to estry glicerolu (alkoholu zawierającego trzy grupy hydroksylowe) i trzech cząsteczek kwasów tłuszczowych. Reakcja ta zachodzi w organizmach żywych i jest kluczowa dla magazynowania energii.
Przykładowo, glicerol może reagować z trzema cząsteczkami kwasu palmitynowego, tworząc palmitynian triglicerydu (tripalmitynę).
Synteza Poliestrów
Poliestry to polimery powstające w wyniku poliestryfikacji – reakcji, w której monomery zawierające grupy karboksylowe i hydroksylowe łączą się ze sobą, tworząc długie łańcuchy estrowe. Najbardziej znanym przykładem poliestru jest PET (politereftalan etylenu), używany do produkcji butelek PET, włókien tekstylnych i folii.
PET powstaje w wyniku reakcji kwasu tereftalowego z glikolem etylenowym.
Znaczenie Estryfikacji w Życiu Codziennym
Jak wspomniano wcześniej, estryfikacja odgrywa kluczową rolę w wielu aspektach naszego życia:
- Przemysł spożywczy: Estryfikacja jest wykorzystywana do produkcji aromatów i zapachów spożywczych. Wiele naturalnych aromatów owocowych to estry. Na przykład, octan butylu nadaje zapach bananom, a mrówczan etylu – malinom.
- Przemysł kosmetyczny: Estry są szeroko stosowane w kosmetykach ze względu na swoje właściwości zapachowe, zmiękczające i nawilżające.
- Przemysł farmaceutyczny: Wiele leków, takich jak aspiryna, to estry. Estryfikacja może być wykorzystywana do modyfikacji właściwości farmakokinetycznych leków, np. do zwiększenia ich rozpuszczalności w tłuszczach, co ułatwia ich wchłanianie.
- Przemysł tworzyw sztucznych: Poliestry, takie jak PET, są szeroko stosowane w produkcji opakowań, włókien tekstylnych i innych produktów.
- Przemysł chemiczny: Estry są ważnymi rozpuszczalnikami i substratami w wielu reakcjach chemicznych.
Czynniki Wpływające na Przebieg Estryfikacji
Na przebieg reakcji estryfikacji wpływa szereg czynników, które należy wziąć pod uwagę, aby uzyskać pożądany rezultat:
- Rodzaj kwasu karboksylowego i alkoholu: Reaktywność kwasu karboksylowego zależy od jego struktury. Kwasy alifatyczne są zazwyczaj bardziej reaktywne niż kwasy aromatyczne. Podobnie, reaktywność alkoholu zależy od rzędowości atomu węgla związanego z grupą hydroksylową. Alkohole pierwszorzędowe są zazwyczaj bardziej reaktywne niż alkohole drugorzędowe i trzeciorzędowe.
- Obecność katalizatora: Katalizator kwasowy (np. H2SO4) przyspiesza reakcję estryfikacji.
- Temperatura: Zwiększenie temperatury zazwyczaj przyspiesza reakcję, ale zbyt wysoka temperatura może prowadzić do rozkładu substratów lub produktów.
- Stężenie substratów: Zwiększenie stężenia substratów (kwasu karboksylowego i alkoholu) przesuwa równowagę reakcji w stronę tworzenia estru.
- Usuwanie wody: Usuwanie wody z mieszaniny reakcyjnej przesuwa równowagę reakcji w stronę tworzenia estru.
- Rozpuszczalnik: Wybór odpowiedniego rozpuszczalnika może wpływać na szybkość i wydajność reakcji. Rozpuszczalniki obojętne, które nie reagują z substratami ani produktami, są zazwyczaj preferowane.
Podsumowanie
Estryfikacja to fundamentalna reakcja chemiczna, która odgrywa kluczową rolę w wielu dziedzinach nauki i przemysłu. Od tworzenia aromatycznych zapachów owoców po syntezę leków i materiałów polimerowych, estryfikacja ma ogromny wpływ na nasze codzienne życie. Zrozumienie mechanizmu, czynników wpływających na przebieg oraz konkretnych przykładów reakcji estryfikacji pozwala docenić jej znaczenie i wykorzystać ją w praktyce.
Mamy nadzieję, że ten artykuł pozwolił Ci lepiej zrozumieć fascynujący świat estryfikacji. Pamiętaj, że chemia otacza nas z każdej strony i poznawanie jej tajników może być niezwykle satysfakcjonujące!