Przemiany Energii W Zjawiskach Cieplnych Zadania I Odpowiedzi

Okej, oto artykuł na temat przemian energii w zjawiskach cieplnych, napisany zgodnie z Twoimi instrukcjami.
Zjawiska cieplne są wszechobecne w naszym życiu i stanowią doskonały przykład przemian energii. Energia nigdy nie ginie, tylko zmienia swoją formę. W zjawiskach cieplnych często mamy do czynienia z zamianą energii mechanicznej, elektrycznej, chemicznej lub jądrowej na energię wewnętrzną ciała, która objawia się zmianą jego temperatury.
Wyobraźmy sobie sytuację, gdy pocieramy dłonie o siebie. Wykonujemy pracę mechaniczną, a nasze dłonie stają się cieplejsze. Praca mechaniczna została zamieniona na energię wewnętrzną dłoni, co spowodowało wzrost ich temperatury. Energia ta jest związana z ruchem cząsteczek, z których zbudowane są nasze dłonie. Im szybciej te cząsteczki się poruszają, tym wyższa jest temperatura ciała.
Inny przykład to ogrzewanie wody w czajniku elektrycznym. Energia elektryczna przepływająca przez grzałkę czajnika zamieniana jest na energię wewnętrzną wody. Woda absorbuje energię, a jej temperatura rośnie. Kiedy woda osiągnie temperaturę wrzenia, zaczyna przechodzić w stan gazowy (parę wodną). Do tego procesu również potrzebna jest energia, która dostarcza energii cząsteczkom wody, umożliwiając im oderwanie się od powierzchni cieczy.
Podobne zjawisko zachodzi w silnikach spalinowych. Energia chemiczna zawarta w paliwie (benzynie, oleju napędowym) jest uwalniana podczas spalania. Energia ta powoduje gwałtowny wzrost temperatury gazów w cylindrze silnika. Gazy rozprężają się, wykonując pracę mechaniczną, która napędza tłok, a następnie koła samochodu. Część energii zostaje jednak utracona w postaci ciepła, które jest odprowadzane przez układ chłodzenia.
Przykłady i Obliczenia
Rozważmy sytuację, w której chcemy ogrzać 1 kg wody o 10 stopni Celsjusza. Potrzebna do tego energia zależy od ciepła właściwego wody, które wynosi około 4200 J/(kg*°C). Oznacza to, że aby ogrzać 1 kg wody o 1 stopień Celsjusza, potrzebujemy dostarczyć 4200 J energii.
Zatem, aby ogrzać 1 kg wody o 10 stopni Celsjusza, potrzebujemy:
Q = m * c * ΔT
gdzie:
- Q to ilość energii potrzebna do ogrzania (ciepło)
- m to masa wody (1 kg)
- c to ciepło właściwe wody (4200 J/(kg*°C))
- ΔT to zmiana temperatury (10 °C)
Q = 1 kg * 4200 J/(kg*°C) * 10 °C = 42000 J
Potrzebujemy więc 42000 J energii, aby ogrzać 1 kg wody o 10 stopni Celsjusza.
Kolejny przykład: Mamy żelazko o mocy 1000 W. Chcemy sprawdzić, ile czasu zajmie mu dostarczenie 42000 J energii.
Moc (P) to ilość energii (E) dostarczana w jednostce czasu (t):
P = E / t
Przekształcamy wzór, aby obliczyć czas:
t = E / P
t = 42000 J / 1000 W = 42 s
Zatem żelazko o mocy 1000 W potrzebuje 42 sekund, aby dostarczyć 42000 J energii.
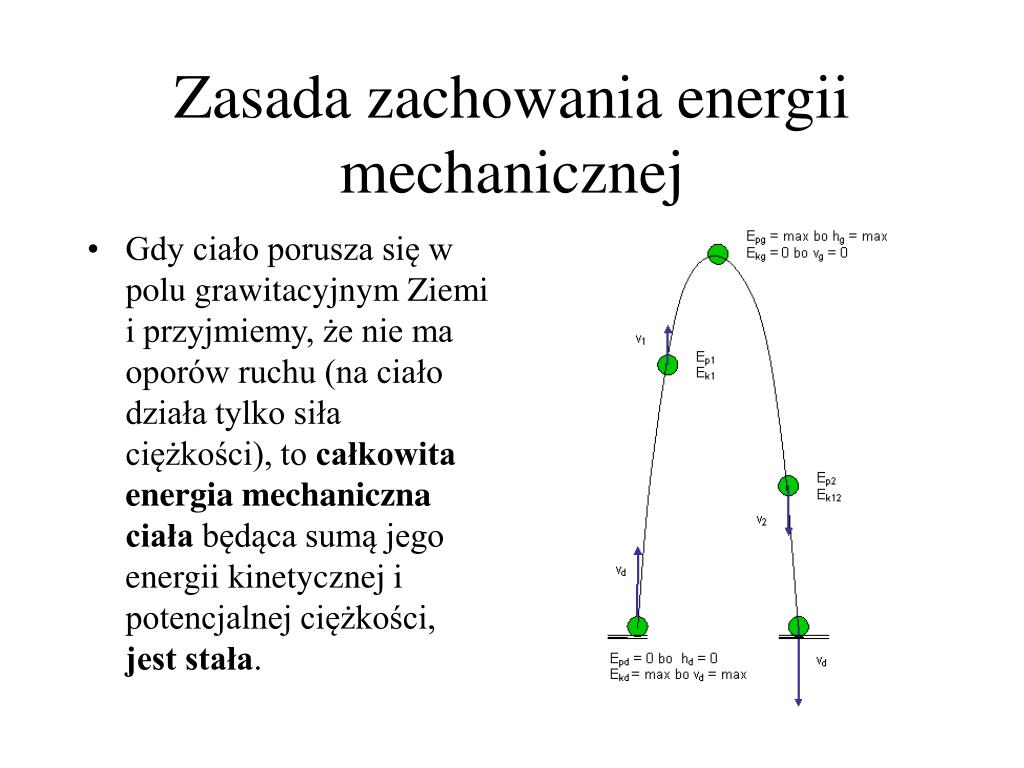
Rozważmy teraz sytuację, w której ciało o masie 2 kg spada z wysokości 5 metrów. Energia potencjalna grawitacji ciała na wysokości 5 metrów zamieni się w energię kinetyczną podczas spadania, a następnie, po uderzeniu w ziemię, w energię wewnętrzną ciała i otoczenia (głównie ciepło).
Energia potencjalna grawitacji (Ep) obliczana jest ze wzoru:
Ep = m * g * h
gdzie:
- m to masa ciała (2 kg)
- g to przyspieszenie ziemskie (około 9.81 m/s²)
- h to wysokość (5 m)
Ep = 2 kg * 9.81 m/s² * 5 m = 98.1 J
Po uderzeniu w ziemię, te 98.1 J energii zostanie zamienione na inne formy energii, głównie na ciepło, ale również na dźwięk i ewentualne odkształcenie ciała lub podłoża.
Zjawiska Zmiany Stanu Skupienia
Przemiany stanu skupienia to kolejne przykłady zjawisk cieplnych związanych z przemianami energii. Podczas topnienia (przejścia ze stanu stałego w ciekły) lub wrzenia (przejścia ze stanu ciekłego w gazowy), substancja pobiera energię, mimo że jej temperatura się nie zmienia. Energia ta jest zużywana na pokonanie sił międzycząsteczkowych i zmianę struktury substancji.
Na przykład, aby stopić lód o temperaturze 0°C, trzeba dostarczyć mu ciepło topnienia. Dla lodu ciepło topnienia wynosi około 334 kJ/kg. Oznacza to, że aby stopić 1 kg lodu o temperaturze 0°C, potrzebujemy dostarczyć 334000 J energii. Podobnie, aby zamienić wodę w parę wodną o temperaturze 100°C, trzeba dostarczyć jej ciepło parowania, które jest znacznie większe niż ciepło topnienia.
Podczas krzepnięcia (przejścia ze stanu ciekłego w stały) lub skraplania (przejścia ze stanu gazowego w ciekły), substancja oddaje energię do otoczenia. Energia ta jest uwalniana, ponieważ cząsteczki układają się w bardziej uporządkowaną strukturę, a siły międzycząsteczkowe stają się silniejsze.
Wszystkie te przykłady pokazują, jak energia przechodzi z jednej formy w drugą w zjawiskach cieplnych. Zrozumienie tych przemian jest kluczowe do zrozumienia wielu procesów zachodzących w przyrodzie i technice. Od ogrzewania domów po działanie silników i elektrowni, przemiany energii w zjawiskach cieplnych odgrywają fundamentalną rolę w naszym życiu.
Mam nadzieję, że to wyjaśnienie jest pomocne!