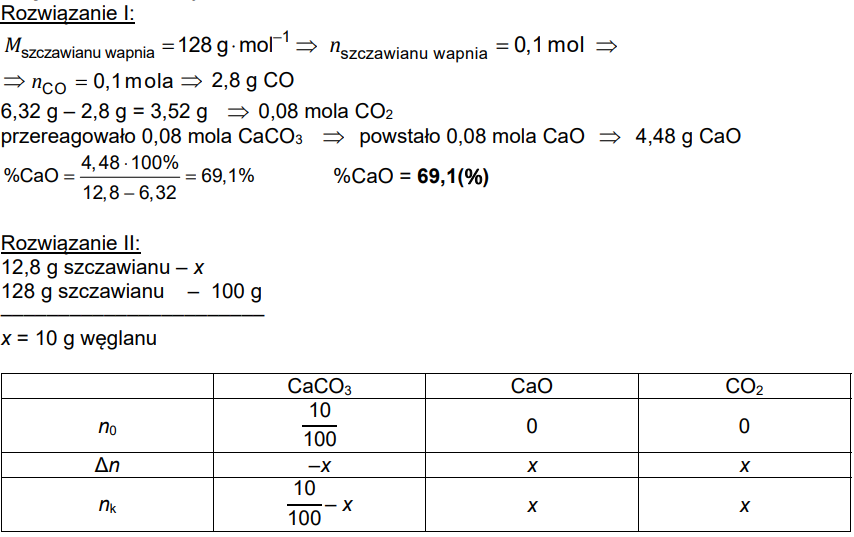
Probke Mieszaniny Weglanu Wapnia I Tlenku Wapnia O Znanej Masie

Załóżmy, że mamy próbkę, która jest mieszaniną węglanu wapnia (CaCO3) i tlenku wapnia (CaO). Znamy masę tej całej próbki i naszym celem jest ustalenie, ile w tej próbce znajduje się węglanu wapnia, a ile tlenku wapnia. Do rozwiązania tego problemu wykorzystamy reakcję chemiczną i stechiometrię.
Aby to zrobić, musimy najpierw poddać naszą mieszaninę reakcji, która pozwoli nam przekształcić jeden ze składników w substancję, którą łatwiej będzie nam zmierzyć. W tym przypadku najczęściej wykorzystywaną metodą jest reakcja z kwasem. Węglan wapnia w reakcji z kwasem solnym (HCl) wydziela dwutlenek węgla (CO2), który możemy zebrać i zważyć. Tlenek wapnia również reaguje z kwasem, ale nie wydziela gazu, który moglibyśmy łatwo zmierzyć.
CaCO3 + 2HCl -> CaCl2 + H2O + CO2 CaO + 2HCl -> CaCl2 + H2O
Załóżmy, że nasza próbka o masie 'm' gramów została potraktowana nadmiarem kwasu solnego. Po zakończeniu reakcji zebraliśmy 'n' gramów dwutlenku węgla. Teraz, korzystając ze stechiometrii reakcji, możemy obliczyć masę węglanu wapnia w próbce.
Masa molowa CaCO3 wynosi około 100 g/mol (40 + 12 + 316). Masa molowa CO2 wynosi około 44 g/mol (12 + 216). Z równania reakcji wynika, że 1 mol CaCO3 daje 1 mol CO2.
Zatem 'n' gramów CO2 odpowiada 'n/44' moli CO2. Zgodnie z równaniem reakcji, liczba moli CO2 jest równa liczbie moli CaCO3, która przereagowała. Zatem w naszej próbce było 'n/44' moli CaCO3.
Mnożąc liczbę moli CaCO3 przez jego masę molową, otrzymujemy masę CaCO3 w próbce: masa CaCO3 = (n/44) * 100 = (100n/44) gramów.
Mając masę CaCO3, możemy obliczyć masę CaO w próbce, odejmując masę CaCO3 od całkowitej masy próbki: masa CaO = m - (100n/44) gramów.
Przykład:
Załóżmy, że masa próbki (m) wynosi 10 gramów, a masa zebranego CO2 (n) wynosi 2,2 grama.
Masa CaCO3 = (100 * 2,2) / 44 = 220 / 44 = 5 gramów.
Masa CaO = 10 - 5 = 5 gramów.
Zatem w tej próbce znajduje się 5 gramów węglanu wapnia i 5 gramów tlenku wapnia.
Teraz rozważmy sytuację, w której zamiast reakcji z kwasem, próbkę poddajemy prażeniu. Prażenie węglanu wapnia powoduje jego rozkład na tlenek wapnia i dwutlenek węgla:
CaCO3 (s) -> CaO (s) + CO2 (g)
Załóżmy, że po prażeniu masa próbki zmniejszyła się o 'p' gramów. To zmniejszenie masy odpowiada masie wydzielonego dwutlenku węgla. Czyli p = masa CO2.
Analogicznie jak poprzednio, masa molowa CO2 wynosi 44 g/mol, a masa molowa CaCO3 wynosi 100 g/mol. Z równania reakcji wynika, że 1 mol CaCO3 daje 1 mol CO2.
Zatem 'p' gramów CO2 odpowiada 'p/44' moli CO2. W związku z tym, przereagowało 'p/44' moli CaCO3.
Masa CaCO3, która uległa rozkładowi to (p/44) * 100 = (100p/44) gramów.
Masa CaO w oryginalnej próbce (przed prażeniem) to: m - (100p/44). To wyrażenie przedstawia masę tlenku wapnia, który był obecny w mieszaninie przed prażeniem węglanu wapnia.
Musimy pamiętać, że prażenie przekształciło również węglan wapnia w tlenek wapnia. Obliczmy ile tlenku wapnia powstało w wyniku prażenia węglanu wapnia. Z reakcji:
CaCO3 (s) -> CaO (s) + CO2 (g)
widzimy, że 1 mol CaCO3 daje 1 mol CaO. Masa molowa CaO wynosi około 56 g/mol (40 + 16). Skoro przereagowało 'p/44' moli CaCO3, to powstało 'p/44' moli CaO. Masa CaO, która powstała w wyniku rozkładu węglanu to (p/44)*56 = (56p/44) gramów.
Zatem całkowita masa tlenku wapnia po prażeniu to: [m - (100p/44)] + (56p/44) = m - (44p/44) = m - p. To potwierdza, że po prażeniu masa próbki zmniejszyła się o masę wydzielonego CO2 (czyli o 'p').
Aby obliczyć masy poszczególnych składników przed prażeniem, musimy wrócić do wyliczeń. Masa CaCO3 w pierwotnej próbce to (100p/44). Masa CaO w pierwotnej próbce to m - (100p/44).
Przykład:
Załóżmy, że masa próbki (m) wynosi 15 gramów, a po prażeniu masa próbki zmniejszyła się o 3,3 grama (p = 3,3).
Masa CaCO3 = (100 * 3,3) / 44 = 330 / 44 = 7,5 gramów.
Masa CaO = 15 - 7,5 = 7,5 gramów.
Zatem w pierwotnej próbce znajduje się 7,5 gramów węglanu wapnia i 7,5 gramów tlenku wapnia.
Inne Metody
Alternatywną metodą jest wykorzystanie różnicy w rozpuszczalności węglanu wapnia i tlenku wapnia w pewnych rozpuszczalnikach. Tlenek wapnia reaguje z wodą tworząc wodorotlenek wapnia (Ca(OH)2), który jest słabo rozpuszczalny, ale rozpuszczalność ta jest znacząco różna od rozpuszczalności węglanu wapnia. Wykorzystując tę różnicę, można, poprzez odpowiednie dozowanie wody i kontrolę warunków, selektywnie rozpuścić tlenek wapnia, a następnie odfiltrować nierozpuszczony węglan wapnia. Po wysuszeniu i zważeniu węglanu wapnia, możemy obliczyć masę tlenku wapnia przez odjęcie. Ta metoda jest bardziej skomplikowana i wymaga precyzyjnej kontroli parametrów procesu, takich jak temperatura i czas trwania.
Jednakże, w praktyce, metody z wykorzystaniem reakcji z kwasem lub prażenia są bardziej powszechne ze względu na ich prostotę i dokładność. Niezależnie od wybranej metody, kluczowe jest precyzyjne wykonanie pomiarów masy i dokładne zrozumienie reakcji chemicznych zachodzących w procesie.
Pamiętajmy o błędach pomiarowych, które zawsze występują w eksperymentach. Starajmy się minimalizować te błędy poprzez użycie precyzyjnych wag i odczynników oraz staranne wykonywanie procedur. Powtarzanie eksperymentu kilkakrotnie i uśrednianie wyników również pomaga w zwiększeniu dokładności.