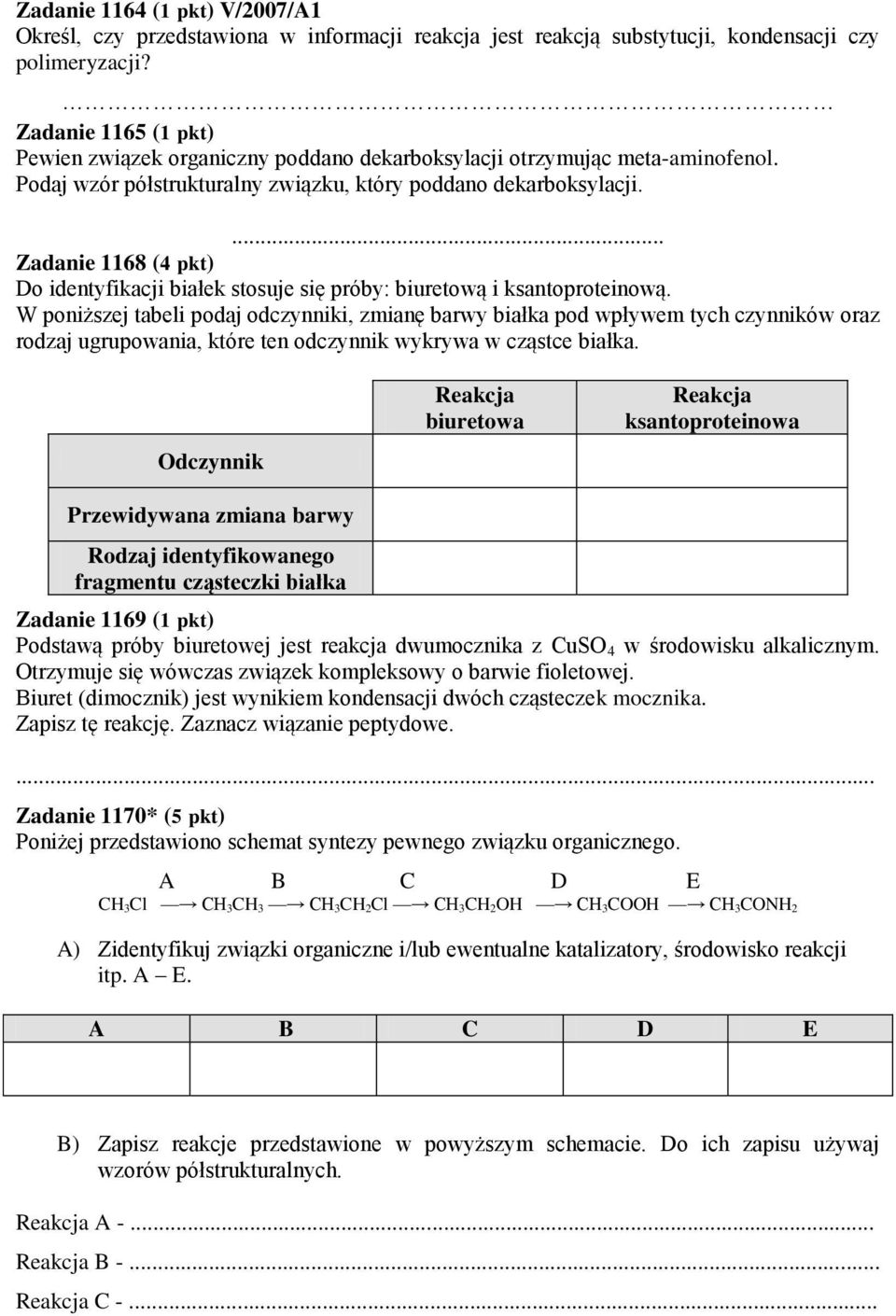
Poniżej Przedstawiono Schemat Syntezy Pewnego Związku Organicznego

Okej, spróbujmy wyjaśnić schemat syntezy związku organicznego krok po kroku, tak jakbym tłumaczył to uczniom w klasie.
Moi drodzy, spójrzmy na ten schemat syntezy. To taki przepis, ale dla chemików. Mamy punkt startowy – jakąś cząsteczkę, i serię reakcji, które krok po kroku prowadzą nas do tego, co chcemy otrzymać na końcu. Pomyślcie o tym jak o budowaniu domu – najpierw fundamenty, potem ściany, dach i na koniec wykończenie.
Pierwszy etap to zazwyczaj reakcja chemiczna, w której nasza początkowa cząsteczka łączy się z czymś, albo coś od niej odczepiamy. Na schemacie zobaczycie strzałkę, a nad nią lub pod nią – co dodajemy i jakie warunki (np. temperatura, katalizator) musimy spełnić, żeby reakcja zaszła. Katalizator to taka pomocna substancja, która przyspiesza reakcję, ale sama się nie zużywa.
Na przykład, jeśli widzimy "H₂ / Pt", oznacza to, że dodajemy wodór (H₂) i używamy platyny (Pt) jako katalizatora. To bardzo często stosowane w uwodornianiu, czyli dodawaniu atomów wodoru do cząsteczki, na przykład do wiązania podwójnego, żeby je przekształcić w wiązanie pojedyncze. Wyobraźcie sobie, że macie rzodkiewkę i chcecie do niej dołączyć dodatkowy listek. Wodór to ten listek, a platyna to sprytne urządzenie, które ułatwia połączenie.
Kolejny etap to kolejna reakcja. I tak dalej, aż do produktu końcowego. Każda reakcja zmienia naszą cząsteczkę, dodając lub odejmując od niej różne grupy funkcyjne. Grupy funkcyjne to takie charakterystyczne "dodatki" do cząsteczki, które decydują o jej właściwościach chemicznych. Mogą to być np. grupy hydroksylowe (-OH), grupy karboksylowe (-COOH), grupy aminowe (-NH₂) i wiele innych. Każda z nich reaguje inaczej i nadaje cząsteczce specyficzne cechy.
Bardzo ważne jest, żeby na schemacie syntezy zwracać uwagę na strzałki i to, co jest nad nimi napisane. To nam mówi, co się dzieje w danym etapie. Często zobaczycie tam nazwy odczynników, rozpuszczalników, katalizatorów, temperatury, ciśnienia, a czasem nawet informacje o tym, jak długo reakcja ma trwać. Wszystko to ma wpływ na to, czy reakcja w ogóle zajdzie i z jaką wydajnością. Wydajność to taka miara, ile produktu końcowego udało nam się uzyskać w stosunku do tego, ile teoretycznie mogliśmy otrzymać. Nie zawsze uda się uzyskać 100% wydajności, bo zawsze są jakieś straty podczas reakcji.
Czasami na schemacie zobaczycie również strzałki z napisami takimi jak "H₂O" (woda) lub "CO₂" (dwutlenek węgla). To oznacza, że te substancje są produktami ubocznymi reakcji. Nie są one tym, co chcemy otrzymać, ale powstają podczas reakcji i trzeba je usunąć z mieszaniny poreakcyjnej.
Typowe Reakcje na Schematach Syntezy
W schematach syntezy często spotykamy pewne typowe reakcje. Na przykład, reakcje addycji, czyli dodawania czegoś do cząsteczki. Albo reakcje substytucji, czyli zamiany jednej grupy na inną. Albo reakcje eliminacji, czyli odczepiania czegoś od cząsteczki.
- Addycja: Mamy związek nienasycony (np. alken z wiązaniem podwójnym) i coś do niego dodajemy, przez co wiązanie podwójne staje się pojedynczym. Przykład: uwodornianie alkenu.
- Substytucja: Jeden atom lub grupa atomów w cząsteczce jest zastępowana przez inny atom lub grupę. Przykład: halogenowanie alkanu, gdzie atom wodoru jest zastępowany przez atom chloru lub bromu.
- Eliminacja: Od cząsteczki odrywają się atomy lub grupy atomów, tworząc wiązanie podwójne lub potrójne. Przykład: dehydratacja alkoholu, gdzie odrywa się woda (H₂O) i powstaje alken.
- Estryfikacja: Reakcja alkoholu z kwasem karboksylowym, w wyniku której powstaje ester i woda.
- Hydroliza: Rozkład związku chemicznego pod wpływem wody. Przykład: hydroliza estru, w wyniku której powstaje kwas karboksylowy i alkohol.
Bardzo często w schematach syntezy zobaczycie również reakcje utleniania i redukcji. Utlenianie polega na zwiększeniu stopnia utlenienia atomu w cząsteczce (czyli oddawaniu elektronów), a redukcja na zmniejszeniu stopnia utlenienia (czyli przyjmowaniu elektronów). Utlenianie często wiąże się z dodawaniem atomów tlenu lub odejmowaniem atomów wodoru, a redukcja – z dodawaniem atomów wodoru lub odejmowaniem atomów tlenu.
Na przykład, utlenianie alkoholu pierwszorzędowego prowadzi do powstania aldehydu, a utlenianie aldehydu prowadzi do powstania kwasu karboksylowego. Redukcja kwasu karboksylowego prowadzi do powstania aldehydu, a redukcja aldehydu prowadzi do powstania alkoholu pierwszorzędowego. To takie "schody" utleniania i redukcji, które warto zapamiętać.
Oprócz samych reakcji, na schemacie syntezy często zobaczycie również informacje o tym, jak oczyścić produkt po każdej reakcji. Często używa się do tego destylacji (czyli oddzielania substancji na podstawie różnicy w temperaturach wrzenia), ekstrakcji (czyli oddzielania substancji na podstawie różnicy w rozpuszczalności) lub krystalizacji (czyli wytrącania substancji z roztworu w postaci kryształów). To ważne, bo czysty produkt jest nam potrzebny do kolejnego etapu syntezy.
Analiza konkretnego przykładu
Powiedzmy, że mamy schemat syntezy, który zaczyna się od alkoholu i prowadzi do estru. Pierwszy etap może polegać na utlenieniu alkoholu do kwasu karboksylowego. Nad strzałką zobaczymy pewnie jakiś silny utleniacz, na przykład KMnO₄ (nadmanganian potasu) lub K₂Cr₂O₇ (dwuchromian potasu). Następnie, w drugim etapie, kwas karboksylowy reaguje z innym alkoholem w obecności katalizatora kwasowego (np. H₂SO₄ – kwas siarkowy). To właśnie reakcja estryfikacji, w wyniku której powstaje ester i woda. Nad strzałką zobaczymy więc informację o tym, że dodajemy alkohol i kwas siarkowy jako katalizator. Na końcu, żeby oczyścić ester, możemy użyć destylacji.
Analizując schemat, warto zadać sobie pytania:
- Jaka jest cząsteczka startowa?
- Jaki jest produkt końcowy?
- Jakie grupy funkcyjne są obecne w cząsteczce startowej i w produkcie końcowym?
- Jakie reakcje zachodzą w poszczególnych etapach?
- Jakie odczynniki, katalizatory i warunki reakcji są używane?
- Jak oczyszcza się produkt po każdej reakcji?
Odpowiadając na te pytania, krok po kroku, zrozumiecie, co się dzieje w syntezie i dlaczego tak, a nie inaczej. To jak rozwiązywanie zagadki, która prowadzi do celu.
Pamiętajcie, że chemia organiczna to nauka eksperymentalna. Teoria jest ważna, ale najważniejsze jest praktyczne zrozumienie, co się dzieje w probówce. Dlatego zachęcam was do czytania publikacji naukowych, analizowania schematów syntez i próbowania prostych reakcji w laboratorium (oczywiście pod okiem doświadczonego nauczyciela!).
Mam nadzieję, że to wyjaśnienie było pomocne. Jeśli macie jakieś pytania, śmiało pytajcie. Powodzenia!