Położenie Pierwiastka W Układzie Okresowym

Zastanawiałeś się kiedyś, jak to możliwe, że z tak wielu różnych pierwiastków powstaje cała otaczająca nas rzeczywistość? Od komputera, na którym czytasz ten tekst, po powietrze, którym oddychasz – wszystko to budowane jest z atomów, uporządkowanych w pewien logiczny sposób. Kluczem do zrozumienia tej uporządkowanej różnorodności jest Układ Okresowy Pierwiastków. To swego rodzaju mapa, która nie tylko pokazuje, jakie pierwiastki istnieją, ale także, jak są ze sobą powiązane i jakie mają właściwości. Ale jak odnaleźć dany pierwiastek na tej mapie i co nam to mówi o jego charakterze?
Układ Okresowy: Twój Przewodnik po Świecie Pierwiastków
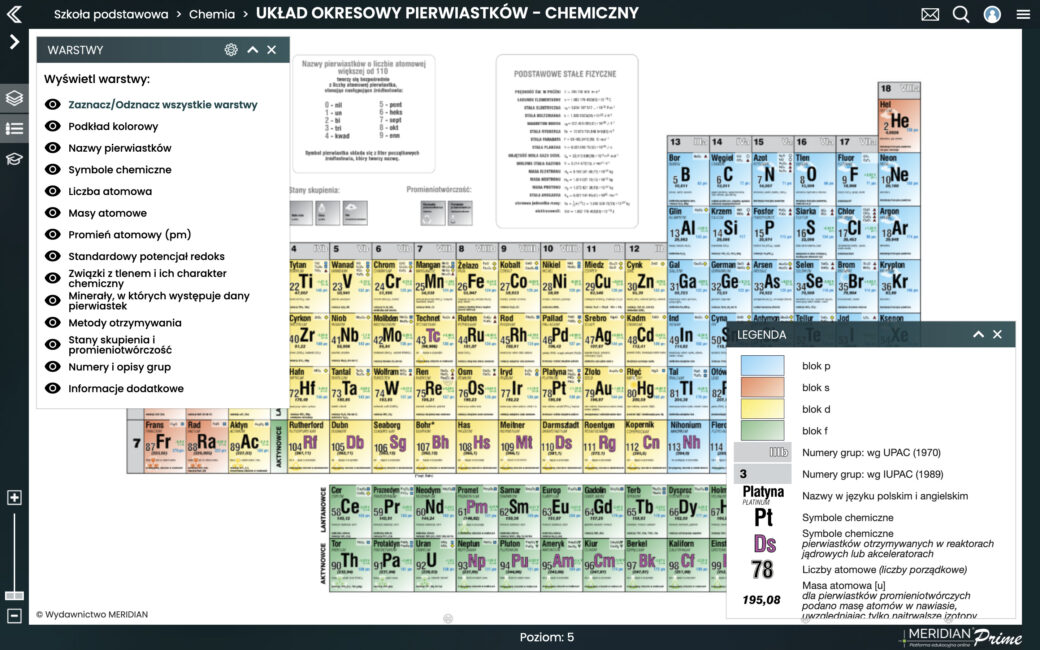
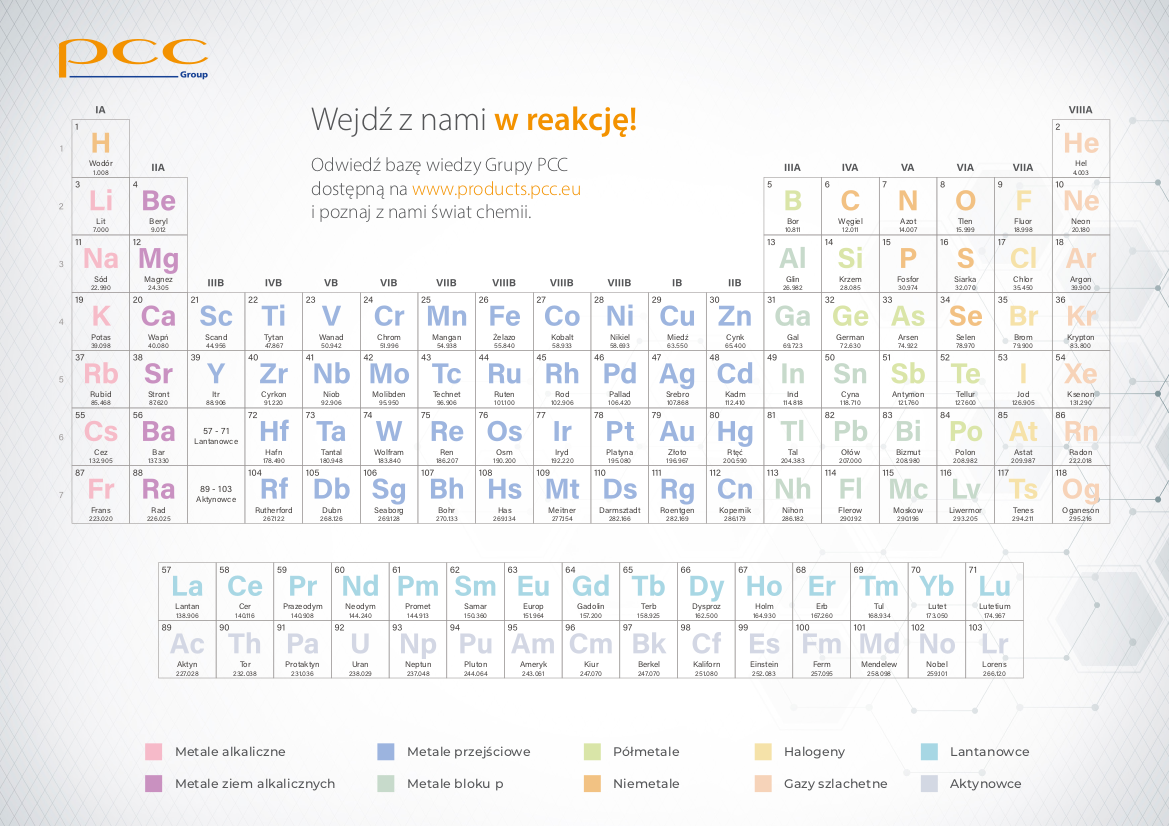
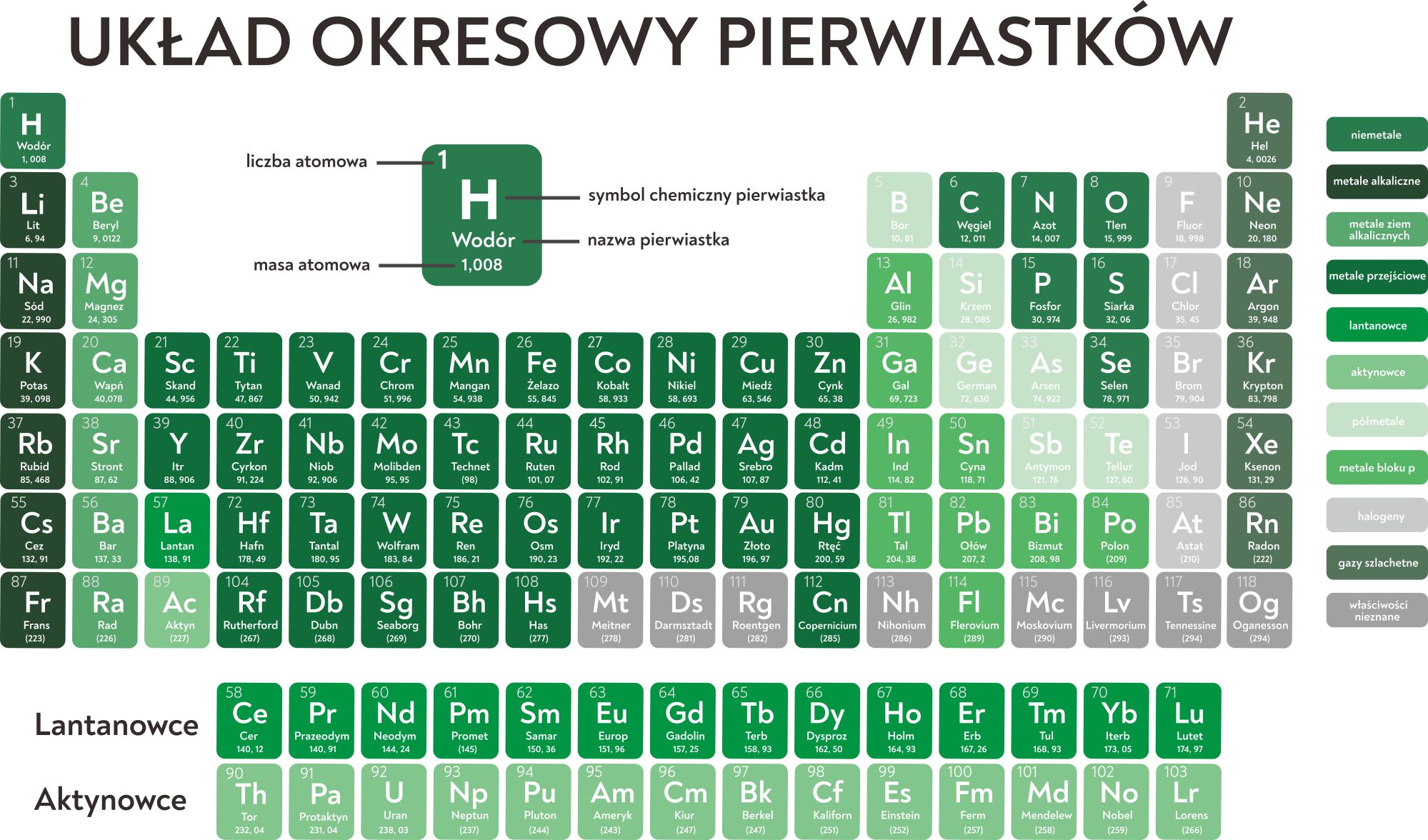
Wyobraź sobie Układ Okresowy jako ogromną tabelę, podzieloną na rzędy (okresy) i kolumny (grupy). Każde pole tej tabeli jest zarezerwowane dla jednego, konkretnego pierwiastka. Ale to nie jest tylko przypadkowe rozmieszczenie – pozycja każdego pierwiastka jest ściśle związana z jego budową atomową i właściwościami chemicznymi.
Okresy: Poziome Rzędy Ujawniające Liczbę Powłok Elektronowych
Każdy okres w Układzie Okresowym reprezentuje liczbę powłok elektronowych, które posiada atom danego pierwiastka. Innymi słowy, pierwiastki znajdujące się w tym samym okresie mają taką samą liczbę powłok, na których krążą elektrony wokół jądra. Na przykład:
- Pierwiastki z pierwszego okresu (wodór i hel) mają tylko jedną powłokę elektronową (K).
- Pierwiastki z drugiego okresu (lit, beryl, bor, węgiel, azot, tlen, fluor i neon) mają dwie powłoki elektronowe (K i L).
W miarę przesuwania się w prawo w obrębie okresu, liczba elektronów na zewnętrznej powłoce (elektrony walencyjne) wzrasta. To właśnie elektrony walencyjne decydują o tym, jak dany pierwiastek będzie reagował z innymi pierwiastkami, czyli o jego właściwościach chemicznych.
Grupy: Pionowe Kolumny Prezentujące Podobieństwo Właściwości
Grupy, czyli pionowe kolumny w Układzie Okresowym, grupują pierwiastki, które mają podobne właściwości chemiczne. Dzieje się tak, ponieważ pierwiastki w tej samej grupie mają tę samą liczbę elektronów walencyjnych (z pewnymi wyjątkami, szczególnie w przypadku metali przejściowych). Przykładowo:
- Pierwsza grupa (litowce): Lit, sód, potas, rubid, cez i frans. Wszystkie te pierwiastki mają jeden elektron walencyjny, co czyni je bardzo reaktywnymi. Reagują gwałtownie z wodą, tworząc zasady.
- Siedemnasta grupa (halogeny): Fluor, chlor, brom, jod i astat. Wszystkie te pierwiastki mają siedem elektronów walencyjnych, co czyni je bardzo reaktywnymi i dążącymi do uzyskania ośmiu elektronów na zewnętrznej powłoce poprzez reagowanie z innymi pierwiastkami.
- Osiemnasta grupa (gazy szlachetne): Hel, neon, argon, krypton, ksenon i radon. Posiadają pełną zewnętrzną powłokę elektronową (8 elektronów, z wyjątkiem helu, który ma 2), co czyni je bardzo stabilnymi i niereaktywnymi.
Znajomość grupy, do której należy dany pierwiastek, pozwala przewidzieć wiele jego właściwości, takich jak reaktywność, właściwości kwasowo-zasadowe tlenków czy zdolność do tworzenia wiązań.
Liczba Atomowa: Unikalny Identyfikator Pierwiastka
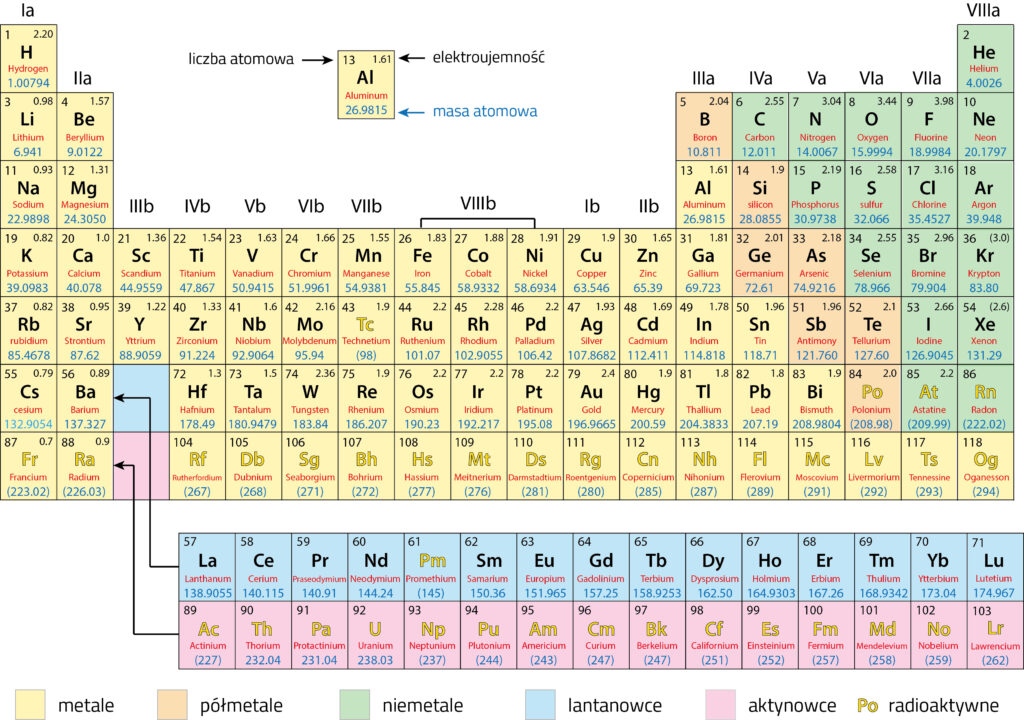
Każdy pierwiastek ma swoją unikalną liczbę atomową, która określa liczbę protonów w jądrze atomowym. Liczba atomowa jest kluczowa, ponieważ decyduje o tym, jakim pierwiastkiem jest dany atom. W Układzie Okresowym pierwiastki są ułożone w kolejności rosnącej liczby atomowej, co oznacza, że idąc od lewej do prawej i od góry do dołu, liczba protonów w jądrze atomowym rośnie o jeden dla każdego kolejnego pierwiastka.
Na przykład, wodór ma liczbę atomową 1 (jeden proton), hel ma liczbę atomową 2 (dwa protony), lit ma liczbę atomową 3 (trzy protony) i tak dalej.
Masa Atomowa: Średnia Masa Izotopów Pierwiastka
Oprócz liczby atomowej, każdy pierwiastek charakteryzuje się również masą atomową. Masa atomowa to średnia masa atomów danego pierwiastka, uwzględniająca naturalne występowanie różnych izotopów. Izotopy to atomy tego samego pierwiastka, które mają różną liczbę neutronów w jądrze atomowym, a więc różnią się masą.
Masa atomowa jest wyrażana w jednostkach masy atomowej (u) lub w gramach na mol (g/mol). W Układzie Okresowym masa atomowa jest zwykle podawana pod symbolem pierwiastka.
Jak Znaleźć Pierwiastek w Układzie Okresowym: Krok po Kroku
Załóżmy, że chcesz znaleźć informacje o żelazie (Fe) w Układzie Okresowym. Oto, jak to zrobić:
- Znajdź symbol pierwiastka (Fe): Przeszukaj tabelę Układu Okresowego, aż znajdziesz pole oznaczone symbolem "Fe".
- Odczytaj liczbę atomową: Liczba atomowa żelaza wynosi 26. Oznacza to, że atom żelaza ma 26 protonów w jądrze.
- Odczytaj masę atomową: Masa atomowa żelaza wynosi około 55.845 u.
- Zidentyfikuj okres i grupę: Żelazo znajduje się w 4 okresie i 8 grupie Układu Okresowego.
- Zinterpretuj położenie: Na podstawie położenia żelaza w Układzie Okresowym, możesz wywnioskować, że jest to metal przejściowy, o charakterystycznych właściwościach, takich jak dobre przewodnictwo elektryczne i cieplne, kowalność i ciągliwość. Możesz również przewidzieć jego właściwości chemiczne i zdolność do tworzenia różnych związków.
Dlaczego Położenie w Układzie Okresowym Ma Znaczenie?
Położenie pierwiastka w Układzie Okresowym to nie tylko adres na mapie. To informacja, która pozwala nam zrozumieć jego podstawowe właściwości i zachowanie. Dzięki tej wiedzy możemy:
- Przewidywać reakcje chemiczne: Wiedząc, jakie elektrony walencyjne posiada dany pierwiastek, możemy przewidzieć, z którymi innymi pierwiastkami będzie reagował i jakie związki utworzy.
- Projektować nowe materiały: Znając właściwości pierwiastków, możemy łączyć je w nowe materiały o pożądanych cechach, np. superwytrzymałe stopy metali lub przewodzące polimery.
- Rozumieć procesy biologiczne: Wiele pierwiastków pełni kluczowe role w organizmach żywych. Znajomość ich właściwości pozwala nam zrozumieć, jak działają enzymy, jak transportowany jest tlen we krwi czy jak funkcjonuje system nerwowy.
Podsumowanie
Układ Okresowy to potężne narzędzie, które pozwala nam zrozumieć świat pierwiastków. Położenie każdego pierwiastka w tej tabeli jest ściśle związane z jego budową atomową i właściwościami chemicznymi. Znajomość okresu, grupy, liczby atomowej i masy atomowej pozwala nam przewidywać zachowanie danego pierwiastka i wykorzystywać go w różnych zastosowaniach. Pamiętaj, że Układ Okresowy to nie tylko sucha teoria, ale praktyczny przewodnik po fascynującym świecie atomów i cząsteczek.
"Układ Okresowy to jedno z najważniejszych osiągnięć w historii nauki. To nie tylko tabela, ale cała filozofia." - Glenn Seaborg, amerykański chemik, laureat Nagrody Nobla.