Podziel Wymienione Substancje I Mieszaniny Na Rozpuszczalne W Wodzie

Czy kiedykolwiek zastanawiałeś się, dlaczego cukier rozpuszcza się w herbacie, a olej już nie? A może próbowałeś kiedyś domowymi sposobami usunąć plamę z ubrania i okazało się, że jeden środek działa, a inny kompletnie nie? Właśnie te różnice w zachowaniu substancji wynikają z ich rozpuszczalności w wodzie, a zrozumienie tego zjawiska jest kluczowe w wielu dziedzinach życia, od gotowania i sprzątania, po chemię i biologię. Ten artykuł został stworzony z myślą o osobach, które chcą zrozumieć podstawowe zasady rozpuszczalności, a zwłaszcza o uczniach i studentach, którzy potrzebują usystematyzowanej wiedzy na ten temat.
Czym jest rozpuszczalność i od czego zależy?
Rozpuszczalność to zdolność danej substancji (substancji rozpuszczanej) do tworzenia jednorodnej mieszaniny z inną substancją (rozpuszczalnikiem). W naszym przypadku rozważamy rozpuszczalność w wodzie, która jest jednym z najpopularniejszych i najważniejszych rozpuszczalników na świecie. Mówimy, że substancja jest rozpuszczalna w wodzie, jeśli tworzy z nią roztwór, czyli mieszaninę, w której nie widać gołym okiem składników.
Na rozpuszczalność wpływa wiele czynników, ale do najważniejszych należą:
- Budowa cząsteczkowa: Substancje polarne (posiadające ładunek elektryczny) zazwyczaj dobrze rozpuszczają się w polarnym rozpuszczalniku, jakim jest woda. Substancje niepolarne (bez ładunku elektrycznego) słabo rozpuszczają się w wodzie, ale dobrze w rozpuszczalnikach niepolarnych.
- Siły międzycząsteczkowe: Siły przyciągania między cząsteczkami substancji rozpuszczanej a cząsteczkami wody muszą być silniejsze niż siły przyciągania między cząsteczkami substancji rozpuszczanej ze sobą.
- Temperatura: Zazwyczaj wzrost temperatury zwiększa rozpuszczalność substancji stałych w wodzie, ale może mieć różny wpływ na rozpuszczalność gazów.
- Ciśnienie: Ciśnienie ma niewielki wpływ na rozpuszczalność substancji stałych i ciekłych, ale znacząco wpływa na rozpuszczalność gazów – im wyższe ciśnienie, tym większa rozpuszczalność.
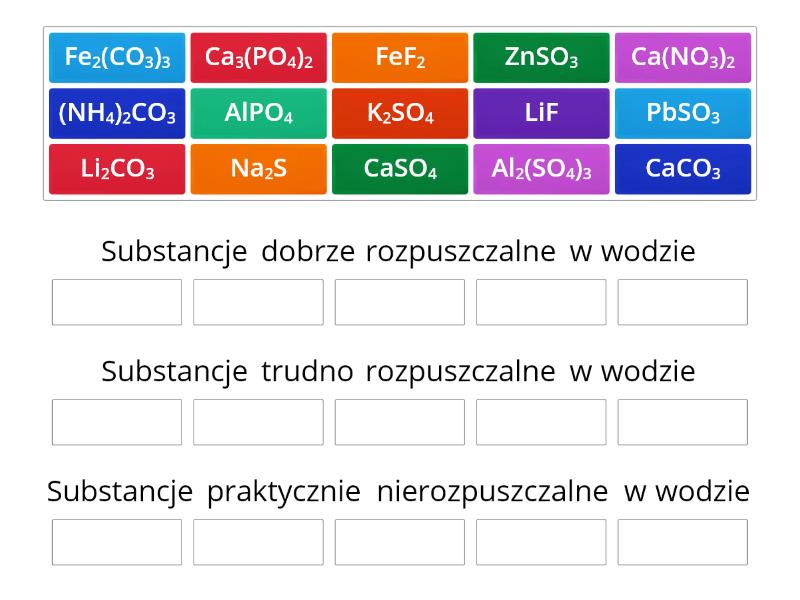
Podział substancji i mieszanin ze względu na rozpuszczalność w wodzie
Substancje i mieszaniny możemy podzielić na kilka kategorii w zależności od ich zachowania w kontakcie z wodą:
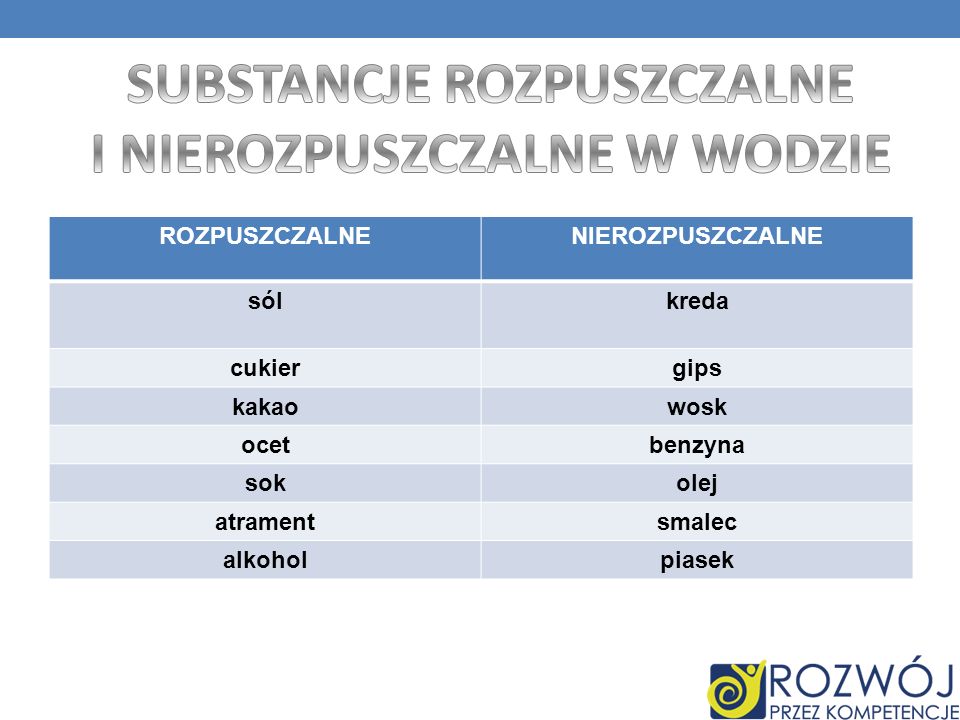
Substancje dobrze rozpuszczalne w wodzie
Substancje te łatwo tworzą roztwory z wodą, nawet w dużych stężeniach. Zazwyczaj są to związki jonowe i polarne związki kowalencyjne:
- Sól kuchenna (NaCl): Jest to klasyczny przykład związku jonowego dobrze rozpuszczalnego w wodzie. Jony sodu (Na+) i chlorku (Cl-) są otaczane przez cząsteczki wody (hydratacja), co powoduje ich oddzielenie i rozpuszczenie.
- Cukier (sacharoza): Sacharoza jest polarnym związkiem organicznym, który zawiera wiele grup hydroksylowych (-OH). Grupy te tworzą wiązania wodorowe z cząsteczkami wody, co umożliwia rozpuszczenie cukru.
- Alkohol etylowy (etanol): Etanol jest polarny dzięki obecności grupy hydroksylowej (-OH) i miesza się z wodą w każdym stosunku.
- Kwasy (np. kwas solny HCl): Kwasy rozpuszczają się w wodzie, tworząc jony wodorowe (H+) i aniony (np. Cl- w przypadku kwasu solnego).
- Zasady (np. wodorotlenek sodu NaOH): Zasady rozpuszczają się w wodzie, tworząc jony wodorotlenkowe (OH-) i kationy (np. Na+ w przypadku wodorotlenku sodu).
Dlaczego te substancje się rozpuszczają? Cząsteczki wody są polarne, co oznacza, że mają częściowy ładunek dodatni (na atomach wodoru) i częściowy ładunek ujemny (na atomie tlenu). Dzięki temu woda może oddziaływać z innymi substancjami polarnymi i jonowymi, osłabiając siły przyciągania między ich cząsteczkami i umożliwiając rozpuszczenie.
Substancje słabo rozpuszczalne w wodzie
Substancje te rozpuszczają się w wodzie w bardzo niewielkim stopniu. Zazwyczaj są to związki o charakterze pośrednim, pomiędzy polarnym a niepolarnym, lub związki jonowe, w których siły oddziaływania między jonami są bardzo silne:
- Gips (CaSO4): Rozpuszczalność gipsu w wodzie jest niska, ale wystarczająca do jego wykorzystania w budownictwie (np. do wiązania).
- Siarczan baru (BaSO4): Jest praktycznie nierozpuszczalny w wodzie i dlatego jest używany jako środek kontrastowy w badaniach rentgenowskich układu pokarmowego.
Dlaczego te substancje rozpuszczają się słabo? W przypadku gipsu siły oddziaływania między jonami wapnia i siarczanu są silne, a hydratacja jonów nie jest wystarczająca, aby całkowicie rozerwać sieć krystaliczną. W przypadku siarczanu baru, te siły są jeszcze silniejsze.
Substancje nierozpuszczalne w wodzie
Substancje te w ogóle nie rozpuszczają się w wodzie lub rozpuszczają się w stopniu znikomym. Zazwyczaj są to związki niepolarne:
- Olej (np. olej roślinny): Olej składa się głównie z długich łańcuchów węglowodorowych, które są niepolarne. Cząsteczki oleju oddziałują ze sobą słabymi siłami van der Waalsa, a siły oddziaływania między olejem a wodą są jeszcze słabsze.
- Benzyna: Podobnie jak olej, benzyna składa się z węglowodorów i jest niepolarna.
- Większość tłuszczów: Tłuszcze, podobnie jak oleje, składają się głównie z niepolarnych łańcuchów węglowodorowych.
- Piasek (SiO2): Chociaż krzemionka jest związkiem polarnym, to tworzy bardzo silną sieć krystaliczną, której cząsteczki wody nie są w stanie rozerwać.
Dlaczego te substancje się nie rozpuszczają? Cząsteczki niepolarne nie oddziałują z cząsteczkami wody. Woda "preferuje" oddziaływanie z innymi cząsteczkami wody (tworząc wiązania wodorowe) niż z cząsteczkami niepolarnymi. Dlatego olej i woda się nie mieszają, tworząc dwie oddzielne warstwy.
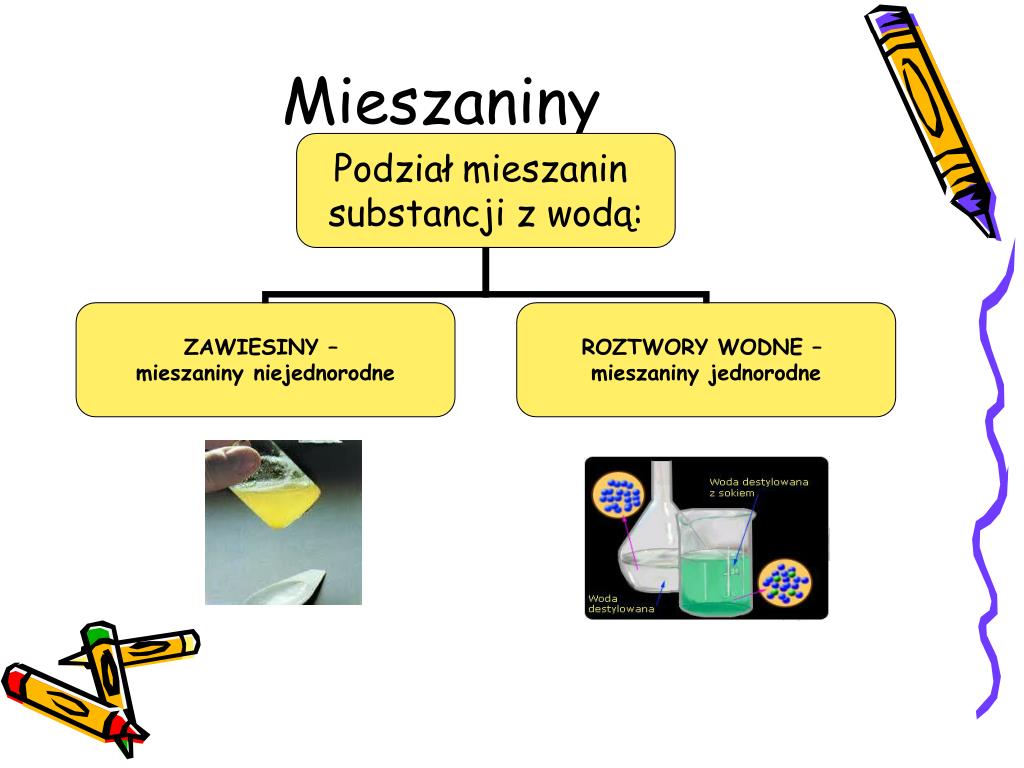
Mieszaniny i ich rozpuszczalność
W przypadku mieszanin sprawa jest bardziej skomplikowana, ponieważ rozpuszczalność zależy od składu mieszaniny. Możemy wyróżnić:
- Mieszaniny jednorodne: Składniki są równomiernie rozproszone w całej objętości, np. roztwór soli w wodzie. W takim przypadku mówimy o rozpuszczalności całej mieszaniny.
- Mieszaniny niejednorodne: Składniki są widoczne gołym okiem lub pod mikroskopem, np. piasek w wodzie. W takim przypadku mówimy o rozpuszczalności poszczególnych składników mieszaniny.
Przykładowo:
- Woda z piaskiem: Mieszanina niejednorodna. Piasek jest nierozpuszczalny w wodzie, więc po pewnym czasie opadnie na dno naczynia.
- Woda z olejem: Mieszanina niejednorodna. Olej jest nierozpuszczalny w wodzie, więc utworzy warstwę na powierzchni wody.
- Woda z solą i piaskiem: Sól rozpuści się w wodzie tworząc roztwór, natomiast piasek pozostanie nierozpuszczony i opadnie na dno.
Zastosowania wiedzy o rozpuszczalności
Zrozumienie rozpuszczalności substancji jest niezwykle przydatne w wielu dziedzinach:
- Gotowanie: Wiedza o tym, co rozpuszcza się w wodzie, a co nie, pozwala na przygotowanie smacznych i estetycznych potraw. Na przykład, wiemy, że cukier rozpuści się w herbacie, a olej nie.
- Sprzątanie: Dzięki wiedzy o rozpuszczalności możemy skutecznie usuwać plamy. Na przykład, plamę z tłuszczu lepiej usunąć rozpuszczalnikiem niepolarnym, a plamę z kawy – wodą.
- Chemia: Rozpuszczalność jest kluczowym parametrem w reakcjach chemicznych. Wiele reakcji zachodzi tylko wtedy, gdy reagenty są rozpuszczone w odpowiednim rozpuszczalniku.
- Farmacja: Rozpuszczalność leków ma ogromny wpływ na ich wchłanianie i skuteczność działania.
- Biologia: Rozpuszczalność substancji w wodzie jest fundamentalna dla życia, ponieważ woda jest podstawowym rozpuszczalnikiem w organizmach żywych.
Przykład z życia: Wyobraź sobie, że chcesz zrobić domowy płyn do mycia okien. Wiesz, że potrzebujesz wody, alkoholu (który rozpuszcza tłuszcze) i octu (który rozpuszcza osad wapienny). Dzięki wiedzy o rozpuszczalności wiesz, że wszystkie te składniki połączą się w jednorodny roztwór, co zapewni skuteczne czyszczenie.
Podsumowanie
Rozpuszczalność substancji w wodzie to fundamentalne zjawisko, które ma wpływ na wiele aspektów naszego życia. Zrozumienie, od czego zależy rozpuszczalność i jak klasyfikować substancje ze względu na ich rozpuszczalność, pozwala nam lepiej radzić sobie w codziennych sytuacjach, a także pogłębiać wiedzę z zakresu chemii, biologii i innych nauk. Pamiętaj, że rozpuszczalność zależy od budowy cząsteczkowej, sił międzycząsteczkowych, temperatury i ciśnienia. Mam nadzieję, że ten artykuł pomógł Ci zrozumieć to ważne zagadnienie i zachęcił do dalszego zgłębiania tajników świata chemii!
"Wiedza jest jak ogród: jeśli się nią nie pielęgnuje, nie można zebrać plonów."
.jpg)