Podsumowanie Działu 1 Chemia Klasa 7
Rozpoczynając przygodę z chemią w siódmej klasie, wielu z Was czuje się zapewne trochę zagubionych. Nowe słownictwo, abstrakcyjne koncepcje, dziwne wzory – wszystko to może przytłaczać. Ale nie martwcie się! Chemia to fascynująca dziedzina, która tłumaczy świat wokół nas. Spróbujmy to wszystko uporządkować i zrozumieć. Pomyślcie, że wchodzicie do laboratorium pełnego tajemnic, które zaraz razem odkryjemy.
Ten artykuł ma za zadanie pomóc Wam zrozumieć i usystematyzować materiał z działu 1 chemii w klasie 7. Skupimy się na najważniejszych zagadnieniach, używając prostego języka i przykładów z życia codziennego. Zobaczycie, że chemia to nie tylko sucha teoria, ale przede wszystkim praktyczna wiedza, która pomoże Wam lepiej rozumieć świat.
Wprowadzenie do chemii – Co to w ogóle jest?
Chemia to nauka, która zajmuje się badaniem właściwości, składu, struktury i przemian materii. Brzmi skomplikowanie? Spróbujmy prościej. Pomyślcie o wszystkim, co Was otacza: powietrze, woda, jedzenie, ubrania. Wszystko to składa się z maleńkich cząsteczek, a chemia bada, jak te cząsteczki są zbudowane i jak się ze sobą łączą, tworząc różne substancje.
Real-world impact: Zastanawialiście się kiedyś, dlaczego pieczemy ciasta? Chemia wyjaśnia, dlaczego mieszanka mąki, jajek i cukru, pod wpływem temperatury, zamienia się w pyszny wypiek. A dlaczego mydło usuwa brud? Również chemia daje nam odpowiedź. Od produkcji lekarstw, przez tworzenie nowych materiałów, po analizę składu gleby – chemia jest wszędzie!
Substancje i mieszaniny
Na początek musimy rozróżnić dwa podstawowe pojęcia: substancje i mieszaniny.
- Substancja to materiał o stałym składzie i określonych właściwościach. Przykładem jest czysta woda (H2O), sól kuchenna (NaCl) czy cukier (sacharoza). Substancje dzielimy na pierwiastki i związki chemiczne.
- Mieszanina to połączenie dwóch lub więcej substancji, które nie reagują ze sobą chemicznie. Przykładem jest powietrze (mieszanina azotu, tlenu i innych gazów), herbata z cukrem czy sałatka warzywna.
Counterpoint: Niektórzy mogą uważać, że rozróżnienie między substancjami a mieszaninami jest czysto teoretyczne. Jednak to rozróżnienie jest kluczowe do zrozumienia, jak oddzielać składniki mieszanin i jak identyfikować różne substancje chemiczne.
Pierwiastki i związki chemiczne
Pierwiastki to najprostsze substancje, których nie można rozłożyć na prostsze składniki metodami chemicznymi. Każdy pierwiastek składa się z atomów tego samego rodzaju. Znacie pewnie węgiel (C), tlen (O), wodór (H) czy żelazo (Fe). Wszystkie pierwiastki są uporządkowane w układzie okresowym pierwiastków, który jest jak mapa drogowskazowa w świecie chemii.
Związki chemiczne powstają, gdy dwa lub więcej pierwiastków łączą się ze sobą chemicznie. Mają one określony skład i właściwości, które różnią się od właściwości pierwiastków, z których powstały. Na przykład, woda (H2O) to związek chemiczny powstały z połączenia wodoru i tlenu. Sól kuchenna (NaCl) to związek chemiczny powstały z połączenia sodu i chloru.
Analogy: Pomyślcie o pierwiastkach jak o literach alfabetu. Pojedyncze litery mają swoje brzmienie, ale dopiero połączenie ich w słowa tworzy sens. Podobnie, pierwiastki mają swoje właściwości, ale dopiero połączenie ich w związki chemiczne tworzy nowe substancje o odmiennych właściwościach.
Metody rozdzielania mieszanin
Skoro wiemy już, czym są mieszaniny, warto dowiedzieć się, jak można rozdzielić je na poszczególne składniki. Istnieje wiele metod rozdzielania mieszanin, a wybór odpowiedniej metody zależy od rodzaju mieszaniny i właściwości jej składników. Oto kilka przykładów:
- Sączenie (filtracja): Stosowane do rozdzielania mieszanin cieczy i ciał stałych, gdzie ciało stałe jest nierozpuszczalne w cieczy. Przykład: oddzielanie piasku od wody za pomocą bibuły filtracyjnej.
- Dekantacja: Polega na zlewaniu cieczy znad osadu. Przydatna, gdy ciało stałe opada na dno naczynia. Przykład: oddzielanie osadu kredy od wody.
- Odparowanie: Stosowane do rozdzielania mieszanin cieczy i ciał stałych, gdzie ciało stałe jest rozpuszczalne w cieczy. Przykład: otrzymywanie soli kuchennej z roztworu soli przez odparowanie wody.
- Destylacja: Stosowana do rozdzielania mieszanin cieczy o różnych temperaturach wrzenia. Przykład: rozdzielanie wody i alkoholu.
- Krystalizacja: Polega na otrzymywaniu kryształów substancji rozpuszczonej w cieczy przez zmianę temperatury lub odparowanie rozpuszczalnika. Przykład: otrzymywanie kryształów cukru z roztworu cukru.
- Chromatografia: Bardziej zaawansowana metoda, pozwalająca na rozdzielanie bardzo skomplikowanych mieszanin, np. barwników.
Stay solution-focused: Zamiast tylko uczyć się definicji, spróbujcie przeprowadzić proste eksperymenty w domu (oczywiście pod nadzorem osoby dorosłej!), aby zobaczyć, jak działają te metody. Spróbujcie odfiltrować fusy od kawy, odparować wodę z roztworu soli, albo oddzielić piasek od żelaza za pomocą magnesu (jeśli macie magnes w domu). To pomoże Wam lepiej zrozumieć teorię.
Właściwości substancji
Każda substancja ma swoje unikalne właściwości, które pozwalają ją zidentyfikować i odróżnić od innych substancji. Właściwości dzielimy na fizyczne i chemiczne.
- Właściwości fizyczne: to te, które można zaobserwować lub zmierzyć bez zmiany składu chemicznego substancji. Należą do nich:
- Stan skupienia (stały, ciekły, gazowy)
- Barwa
- Zapach
- Gęstość
- Temperatura wrzenia i topnienia
- Rozpuszczalność w wodzie
- Przewodnictwo elektryczne i cieplne
- Właściwości chemiczne: opisują zdolność substancji do wchodzenia w reakcje chemiczne i tworzenia nowych substancji. Należą do nich:
- Palność
- Reaktywność z kwasami i zasadami
- Toksyczność
- Korodowanie
Example: Weźmy na przykład wodę. Jej właściwości fizyczne to: stan skupienia (ciekły w temperaturze pokojowej), brak barwy i zapachu, gęstość około 1 g/cm3, temperatura wrzenia 100°C i temperatura topnienia 0°C. Właściwości chemiczne wody to m.in. zdolność do rozpuszczania wielu substancji, reagowanie z niektórymi metalami i udział w procesie fotosyntezy.
Consistent voice: Pamiętajcie, że chemia to nie tylko teoria, ale przede wszystkim obserwacja. Im więcej eksperymentów i doświadczeń przeprowadzicie, tym lepiej zrozumiecie właściwości różnych substancji. Spróbujcie porównać właściwości różnych substancji, które macie w domu (np. sól, cukier, ocet) i zastanówcie się, dlaczego mają one różne zastosowania.
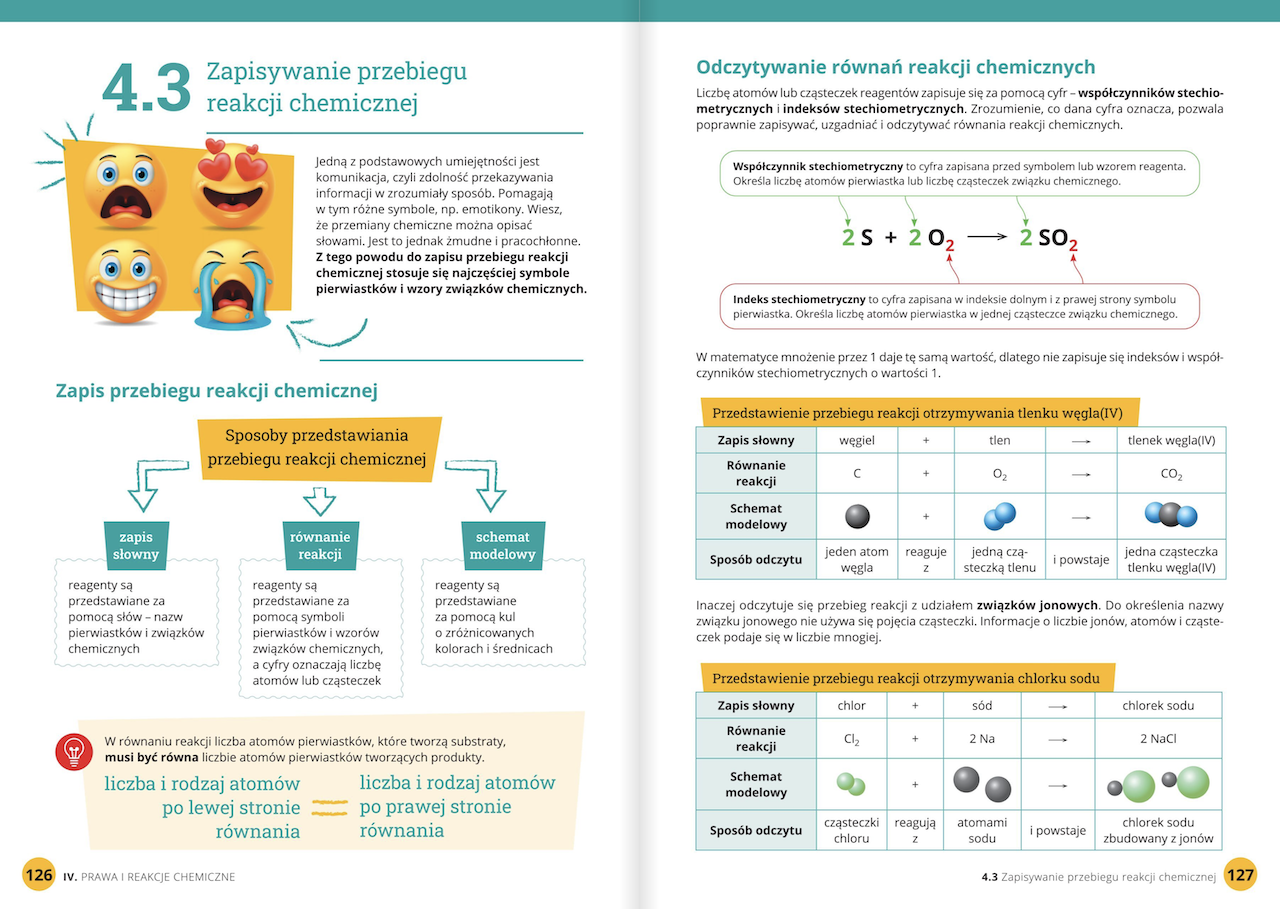
Reakcje chemiczne
Reakcja chemiczna to proces, w którym jedne substancje (substraty) przekształcają się w inne substancje (produkty). Reakcjom chemicznym towarzyszą zmiany energii. Reakcje mogą być egzotermiczne (wydzielają ciepło) lub endotermiczne (pobierają ciepło z otoczenia).
Real-world impact: Gotowanie to seria reakcji chemicznych! Pieczecie ciasto? Reakcja Maillarda powoduje brązowienie powierzchni i tworzy charakterystyczny aromat. Spalanie gazu w kuchence to reakcja chemiczna, która dostarcza ciepło do gotowania. Rdzewienie metalu, trawienie pokarmu, a nawet oddychanie – wszystko to są przykłady reakcji chemicznych.
Example: Prosta reakcja chemiczna to spalanie węgla (C) w tlenie (O2). Produktem jest dwutlenek węgla (CO2). Równanie tej reakcji wygląda następująco: C + O2 → CO2. Jest to reakcja egzotermiczna, czyli podczas spalania węgla wydziela się ciepło.
Address counterpoints: Niektórzy mogą uważać, że równania reakcji chemicznych są skomplikowane i trudne do zapamiętania. Rzeczywiście, początki mogą być trudne, ale z czasem, dzięki praktyce, nauczycie się je pisać i odczytywać. Pamiętajcie, że równania reakcji chemicznych to skrócony zapis tego, co dzieje się podczas reakcji, i ułatwiają zrozumienie procesu.
Podsumowanie i dalsze kroki
Uff, dotarliśmy do końca podsumowania działu 1 chemii w klasie 7! Mam nadzieję, że udało mi się rozwiać Wasze wątpliwości i uporządkować wiedzę. Pamiętajcie, że chemia to nauka eksperymentalna, więc im więcej będziecie obserwować, eksperymentować i zadawać pytań, tym lepiej ją zrozumiecie.
Key takeaways:
- Chemia to nauka o materii i jej przemianach.
- Rozróżniamy substancje (pierwiastki i związki chemiczne) i mieszaniny.
- Istnieją różne metody rozdzielania mieszanin, takie jak sączenie, odparowanie, destylacja.
- Każda substancja ma swoje unikalne właściwości fizyczne i chemiczne.
- Reakcje chemiczne to procesy, w których substancje przekształcają się w inne.
Zadanie domowe (opcjonalne): Znajdźcie w swoim otoczeniu przykłady substancji, mieszanin, metod rozdzielania mieszanin i reakcji chemicznych. Zapiszcie swoje obserwacje i spróbujcie je wyjaśnić, korzystając z wiedzy zdobytej podczas lekcji i z tego artykułu.
A teraz, co dalej? Czy czujecie się gotowi na dalsze odkrywanie fascynującego świata chemii? Jakie pytania pozostały bez odpowiedzi i co chcielibyście zgłębić w kolejnych lekcjach?