Podaj Przykład Substancji W Stanie Stałym Ciekłym I Gazowym

Wokół nas, w każdym momencie naszego życia, nieustannie stykamy się z substancjami w różnych stanach skupienia. Te stany skupienia – stały, ciekły i gazowy – są fundamentalnymi formami materii, różniącymi się od siebie właściwościami fizycznymi, takimi jak kształt, objętość i sposób oddziaływania cząsteczek. Przyjrzyjmy się bliżej kilku konkretnym przykładom substancji występujących w każdym z tych stanów, aby lepiej zrozumieć ich charakterystyczne cechy.
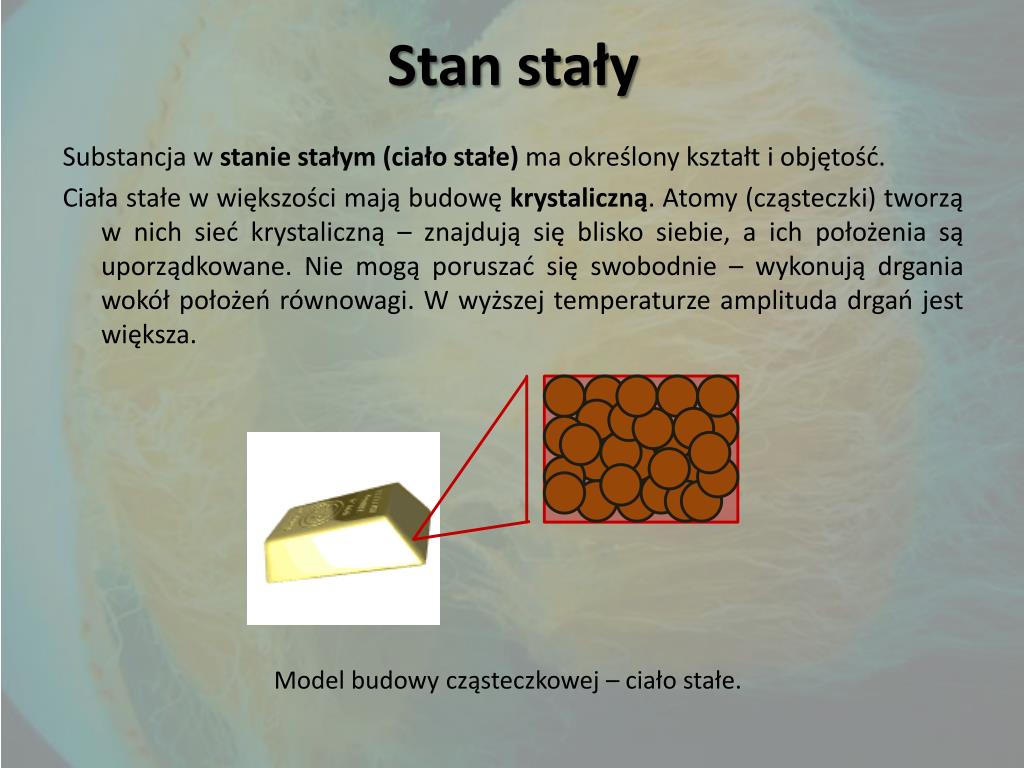
Żelazo, sól kuchenna (chlorek sodu) i diament to doskonałe przykłady substancji stałych. Żelazo, znane ze swojej wytrzymałości i plastyczności, jest szeroko stosowane w budownictwie, przemyśle motoryzacyjnym i wielu innych dziedzinach. Jego atomy są ściśle ułożone w regularną strukturę krystaliczną, co nadaje mu twardość i odporność na odkształcenia. Sól kuchenna, którą codziennie używamy do przyprawiania potraw, również charakteryzuje się strukturą krystaliczną, ale w odróżnieniu od żelaza jest krucha i łatwo rozpuszcza się w wodzie. Diament, będący jednym z najtwardszych znanych materiałów, zawdzięcza swoje wyjątkowe właściwości regularnej sieci atomów węgla, połączonych niezwykle silnymi wiązaniami kowalencyjnymi. Wszystkie te substancje, choć różnią się składem chemicznym i właściwościami, łączy jedna cecha – posiadają określoną objętość i kształt, które trudno zmienić bez użycia znacznej siły. Cząsteczki w ciałach stałych drgają w ustalonych pozycjach, ale nie przemieszczają się swobodnie, co nadaje im sztywność i stabilność.
Woda, alkohol etylowy i olej roślinny to przykłady substancji występujących w stanie ciekłym. Woda, niezbędna do życia, charakteryzuje się zdolnością do rozpuszczania wielu substancji i wysokim napięciem powierzchniowym. Jej cząsteczki, choć nie są tak ściśle ułożone jak w ciałach stałych, wciąż oddziałują ze sobą, co sprawia, że ciecz zachowuje określoną objętość, ale nie ma własnego kształtu – przyjmuje kształt naczynia, w którym się znajduje. Alkohol etylowy, powszechnie stosowany jako rozpuszczalnik i środek dezynfekujący, jest bardziej lotny od wody i ma niższą temperaturę wrzenia. Olej roślinny, będący mieszaniną różnych triglicerydów, charakteryzuje się dużą lepkością i nie rozpuszcza się w wodzie. Ciecze, w przeciwieństwie do ciał stałych, mogą swobodnie płynąć, ponieważ ich cząsteczki mogą przemieszczać się względem siebie. Ta zdolność do płynięcia jest kluczowa dla wielu procesów biologicznych i przemysłowych.
Tlen, azot i dwutlenek węgla to przykłady substancji, które w normalnych warunkach atmosferycznych występują w stanie gazowym. Tlen, niezbędny do oddychania, stanowi około 21% składu powietrza. Azot, będący głównym składnikiem atmosfery (około 78%), jest stosowany w produkcji nawozów i w przemyśle chłodniczym. Dwutlenek węgla, produkt uboczny oddychania i spalania, jest ważnym gazem cieplarnianym, który wpływa na klimat Ziemi. Gazy, w odróżnieniu od ciał stałych i cieczy, nie mają ani określonej objętości, ani określonego kształtu – wypełniają całą dostępną przestrzeń. Cząsteczki gazów poruszają się chaotycznie i niezależnie od siebie, a odległości między nimi są znacznie większe niż w cieczach i ciałach stałych. Gazy są ściśliwe i rozprężliwe, co oznacza, że ich objętość może się łatwo zmieniać pod wpływem ciśnienia i temperatury.
Zastosowanie Stanów Skupienia w Praktyce
Różne stany skupienia materii znajdują szerokie zastosowanie w różnych dziedzinach życia i technologii. Ciała stałe, ze względu na swoją wytrzymałość i stabilność, są wykorzystywane w budownictwie, inżynierii mechanicznej i produkcji narzędzi. Ciecze, dzięki zdolności do płynięcia i rozpuszczania substancji, są używane w transporcie, chłodzeniu, jako rozpuszczalniki i media reakcyjne. Gazy, ze względu na swoją ściśliwość i rozprężliwość, są wykorzystywane w energetyce, przemyśle chemicznym i transporcie.
Zmiany Stanów Skupienia
Warto pamiętać, że substancje mogą przechodzić z jednego stanu skupienia w inny pod wpływem zmian temperatury i ciśnienia. Na przykład, woda może zamarzać w lód (przejście ze stanu ciekłego w stały), parować w parę wodną (przejście ze stanu ciekłego w gazowy) lub sublimować w parę wodną (przejście ze stanu stałego w gazowy). Te przemiany fazowe są fundamentalne dla wielu procesów naturalnych i przemysłowych, takich jak cykl hydrologiczny, destylacja i krystalizacja. Zmiany stanów skupienia wymagają dostarczenia energii (np. ciepła) lub jej odebrania, aby pokonać siły oddziaływania między cząsteczkami. Na przykład, aby stopić lód, należy dostarczyć energię cieplną, która osłabi wiązania w strukturze krystalicznej i umożliwi cząsteczkom wody swobodne przemieszczanie się.