Pierwiastek Chemiczny Którego Atom Zawiera 35 Elektronów
Okej, spróbujmy to rozgryźć krok po kroku, tak żeby było jasne i zrozumiałe. Pytanie dotyczy pierwiastka chemicznego, którego atom ma w sobie 35 elektronów. Kluczem do rozwiązania tej zagadki jest zrozumienie, jak atomy są zbudowane i co to znaczy, że atom jest elektrycznie obojętny.
Atom składa się z jądra i elektronów krążących wokół tego jądra. W jądrze mamy protony, które mają ładunek dodatni, i neutrony, które są elektrycznie obojętne. Elektrony natomiast, krążące wokół jądra, mają ładunek ujemny. Bardzo ważna zasada jest taka, że w atomie obojętnym elektrycznie, liczba protonów w jądrze musi być równa liczbie elektronów krążących wokół jądra. Dlaczego? Bo ładunek dodatni protonów musi zrównoważyć ładunek ujemny elektronów, żeby atom jako całość nie miał żadnego ładunku.
Teraz wracamy do naszego pytania. Szukamy pierwiastka, który ma 35 elektronów. Skoro atom ma być obojętny elektrycznie, to znaczy, że musi mieć również 35 protonów w swoim jądrze. To liczba protonów w jądrze decyduje o tym, jaki to jest pierwiastek. Liczba protonów to po prostu liczba atomowa pierwiastka.
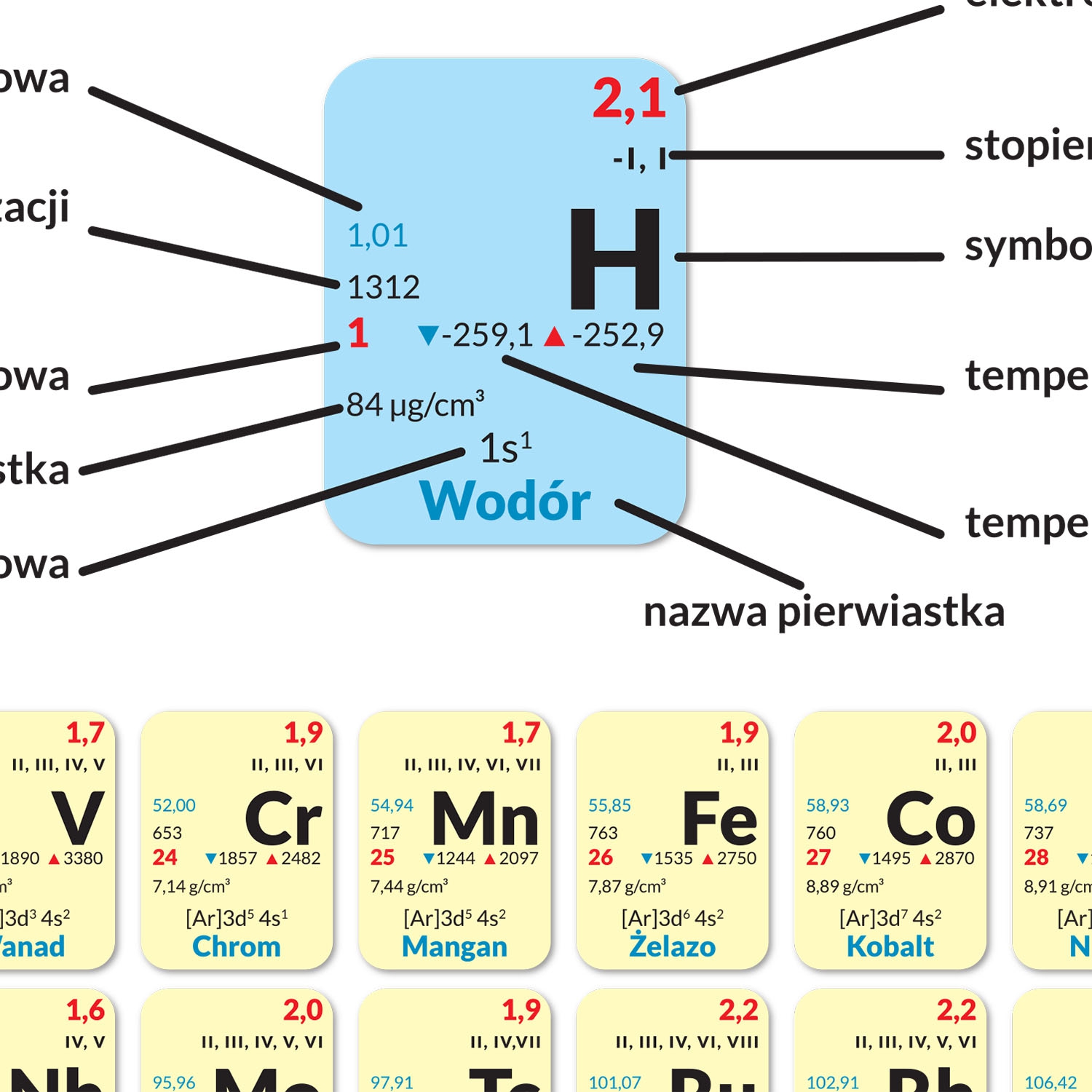
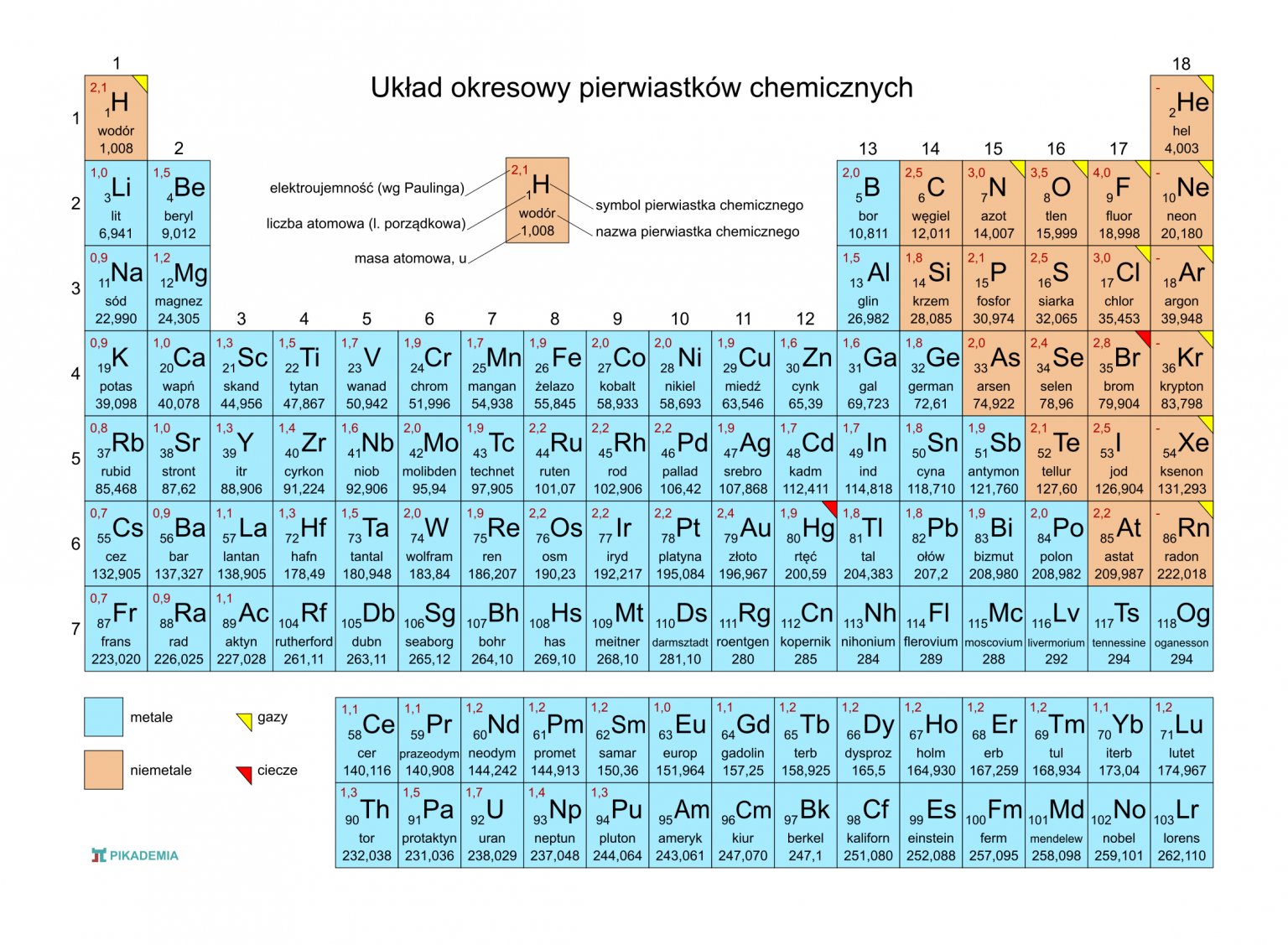
Gdzie znaleźć tę informację? Najprościej zajrzeć do układu okresowego pierwiastków. Układ okresowy to taka "ściąga", gdzie wszystkie znane pierwiastki są ułożone w kolejności rosnącej liczby atomowej. Każdy pierwiastek ma swoje miejsce w układzie, a obok symbolu pierwiastka (np. H dla wodoru, O dla tlenu) zazwyczaj jest podana jego liczba atomowa.
Szukamy w układzie okresowym pierwiastka, który ma liczbę atomową 35. Przesuwamy się po kolei, aż dojdziemy do liczby 35. I co znajdujemy? Pierwiastek o symbolu Br, czyli brom.
Brom to pierwiastek należący do grupy halogenów. Halogeny to pierwiastki, które są bardzo reaktywne i lubią łączyć się z innymi pierwiastkami, tworząc związki chemiczne. Brom w temperaturze pokojowej jest cieczą o czerwonobrunatnej barwie i charakterystycznym, duszącym zapachu. Jest toksyczny i należy się z nim obchodzić ostrożnie.
Właściwości Bromu
Brom, jak już wspomniałem, jest bardzo reaktywny chemicznie. Oznacza to, że chętnie wchodzi w reakcje z innymi pierwiastkami i związkami chemicznymi. Reaguje na przykład z metalami, tworząc sole bromkowe. Reaguje także z wodorem, tworząc bromowodór (HBr), który jest gazem o silnych właściwościach kwasowych.
Brom jest również stosowany w wielu różnych dziedzinach. Na przykład, związki bromu są używane jako środki opóźniające palenie, dodawane do tworzyw sztucznych i tekstyliów, aby zapobiec ich zapaleniu. Są również stosowane w produkcji leków, barwników i środków dezynfekujących.
Teraz, żeby lepiej to zrozumieć, wyobraźmy sobie atom bromu. W jądrze atomu bromu znajduje się 35 protonów i pewna liczba neutronów (liczba neutronów może się różnić, co prowadzi do istnienia izotopów bromu). Wokół jądra krąży 35 elektronów. Te elektrony nie krążą sobie chaotycznie, tylko są ułożone na różnych powłokach elektronowych wokół jądra.
Pierwsza powłoka, najbliżej jądra, może pomieścić maksymalnie 2 elektrony. Druga powłoka może pomieścić maksymalnie 8 elektronów. Trzecia powłoka może pomieścić maksymalnie 18 elektronów, a czwarta powłoka może pomieścić teoretycznie więcej, ale w przypadku bromu, będzie ich tam mniej.
Jak rozmieścimy te 35 elektronów na powłokach? Najpierw obsadzamy pierwszą powłokę dwoma elektronami. Zostaje nam 33 elektrony. Następnie obsadzamy drugą powłokę ośmioma elektronami. Zostaje nam 25 elektronów. Trzecią powłokę obsadzamy 18 elektronami. Zostaje nam 7 elektronów. Te 7 elektronów umieszczamy na czwartej powłoce.
Zatem konfiguracja elektronowa atomu bromu to: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁵. Oznacza to, że na pierwszej powłoce (n=1) mamy 2 elektrony (1s²), na drugiej powłoce (n=2) mamy 8 elektronów (2s² 2p⁶), na trzeciej powłoce (n=3) mamy 18 elektronów (3s² 3p⁶ 3d¹⁰), a na czwartej powłoce (n=4) mamy 7 elektronów (4s² 4p⁵).
Liczba elektronów na ostatniej powłoce (w tym przypadku 7) decyduje o właściwościach chemicznych pierwiastka. Brom, mając 7 elektronów na ostatniej powłoce, dąży do tego, żeby mieć 8 elektronów (zgodnie z regułą oktetu), czyli chętnie przyjmuje jeden elektron od innego atomu, tworząc jon bromkowy (Br⁻).
Zastosowania Bromu i Jego Związków
Wspomniałem już, że związki bromu są używane jako środki opóźniające palenie. Oprócz tego, brom jest stosowany w produkcji:
- Środków dezynfekujących: Brom jest silnym środkiem dezynfekującym i jest używany do odkażania wody w basenach i jacuzzi.
- Leków: Niektóre leki zawierają brom w swojej strukturze. Na przykład, bromek potasu był kiedyś stosowany jako środek uspokajający.
- Barwników: Brom jest używany do produkcji niektórych barwników, szczególnie tych o intensywnych kolorach.
- Pestycydów: Niektóre pestycydy zawierają brom.
Należy jednak pamiętać, że brom i jego związki są toksyczne i należy się z nimi obchodzić ostrożnie. Wdychanie oparów bromu może powodować podrażnienie dróg oddechowych i poważne problemy zdrowotne.
Podsumowując, pierwiastkiem, którego atom zawiera 35 elektronów, jest brom (Br). Ma on liczbę atomową 35, co oznacza, że w jądrze jego atomu znajduje się 35 protonów. Brom jest halogenem, bardzo reaktywnym chemicznie i ma wiele zastosowań, ale należy z nim obchodzić się ostrożnie ze względu na jego toksyczność. Mam nadzieję, że teraz wszystko jest jasne!