Otrzymywania Wodorotlenków

Zastanawiałeś się kiedyś, jak powstają substancje, które wykorzystujemy na co dzień, od leków po materiały budowlane? Często kluczową rolę odgrywają wodorotlenki. Pewnie pomyślisz, że to kolejna skomplikowana chemia, z którą nie masz nic wspólnego. Ale tak naprawdę, wodorotlenki wpływają na nasze życie w bardziej namacalny sposób, niż myślisz. Problemy z nadkwasotą, czyszczenie domu, a nawet neutralizacja szkodliwych substancji – to tylko niektóre przykłady, gdzie wodorotlenki wchodzą do akcji.
Ten artykuł ma na celu przybliżyć proces otrzymywania wodorotlenków w sposób przystępny i zrozumiały. Postaramy się unikać zbędnego żargonu chemicznego, skupiając się na praktycznym aspekcie i zrozumieniu mechanizmów.
Czym są wodorotlenki i dlaczego są ważne?
Wodorotlenki to związki chemiczne, które zawierają grupę hydroksylową (-OH) połączoną z atomem metalu (wodorotlenki metali) lub inną grupą atomów (np. wodorotlenki organiczne). Charakteryzują się odczynem zasadowym (alkalicznym), co oznacza, że w roztworze wodnym zwiększają stężenie jonów wodorotlenkowych (OH-).
Dlaczego wodorotlenki są tak ważne?
- Neutralizacja kwasów: Wodorotlenki reagują z kwasami, tworząc sole i wodę. Ta właściwość jest wykorzystywana w leczeniu nadkwasoty żołądka (wodorotlenek magnezu lub glinu) oraz do neutralizacji szkodliwych substancji chemicznych.
- Produkcja mydeł i detergentów: Wodorotlenek sodu (NaOH) jest kluczowym składnikiem w procesie zmydlania tłuszczów, co prowadzi do powstania mydeł.
- Oczyszczanie wody: Wodorotlenek wapnia (Ca(OH)2), znany jako wapno gaszone, jest używany do uzdatniania wody pitnej i oczyszczania ścieków.
- Przemysł budowlany: Wodorotlenek wapnia jest składnikiem zapraw murarskich i tynków.
- Produkcja papieru: Wodorotlenek sodu jest używany w procesie bielenia pulpy papierniczej.
Metody otrzymywania wodorotlenków
Istnieje kilka głównych metod otrzymywania wodorotlenków. Przyjrzyjmy się im bliżej:
1. Reakcja aktywnych metali z wodą
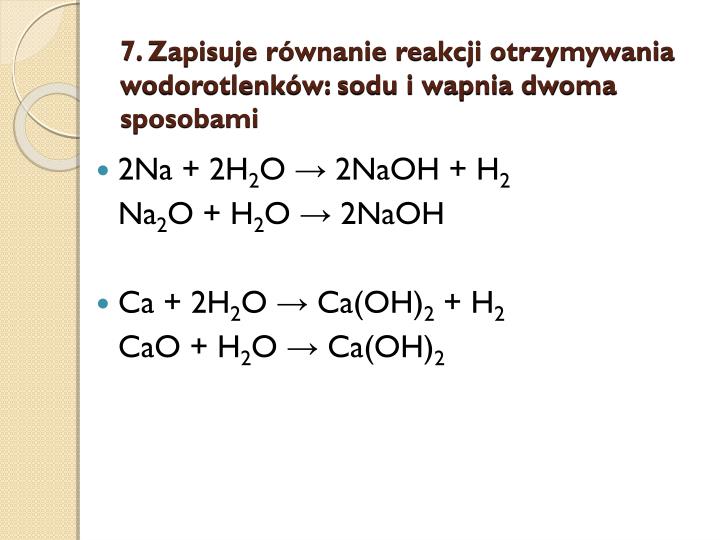
Aktywne metale, takie jak lit (Li), sód (Na), potas (K), rubid (Rb) i cez (Cs), reagują gwałtownie z wodą, tworząc wodorotlenki i wodór. Reakcja jest egzotermiczna, co oznacza, że wydziela się ciepło. Im bardziej aktywny metal, tym gwałtowniejsza reakcja.
Przykład:
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
W tej reakcji sód (Na) reaguje z wodą (H2O), tworząc wodorotlenek sodu (NaOH) i wodór (H2). Wodorotlenek sodu rozpuszcza się w wodzie, tworząc roztwór zasadowy.
Zastosowanie: Ta metoda jest stosowana do otrzymywania wodorotlenków litowców na skalę laboratoryjną.
2. Reakcja tlenków metali z wodą
Tlenki metali z I i II grupy układu okresowego, takie jak tlenek sodu (Na2O) i tlenek wapnia (CaO), reagują z wodą, tworząc wodorotlenki.
Przykłady:
- Na2O(s) + H2O(l) → 2NaOH(aq)
- CaO(s) + H2O(l) → Ca(OH)2(aq)
W pierwszym przypadku tlenek sodu reaguje z wodą, tworząc wodorotlenek sodu. W drugim przypadku tlenek wapnia (wapno palone) reaguje z wodą, tworząc wodorotlenek wapnia (wapno gaszone). Proces ten nazywany jest gaszeniem wapna.
Zastosowanie: Otrzymywanie wodorotlenku wapnia (wapna gaszonego) na skalę przemysłową.
3. Elektroliza roztworów soli
Elektroliza to proces rozkładu substancji pod wpływem prądu elektrycznego. W przypadku roztworów soli, np. chlorku sodu (NaCl), elektroliza prowadzi do powstania wodorotlenku sodu (NaOH), chloru (Cl2) i wodoru (H2).
Reakcja:
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g)
W tym procesie jony chlorkowe (Cl-) utleniają się na anodzie, tworząc chlor, a woda redukuje się na katodzie, tworząc wodór i jony wodorotlenkowe (OH-). Jony wodorotlenkowe reagują z jonami sodu (Na+) w roztworze, tworząc wodorotlenek sodu.
Zastosowanie: Otrzymywanie wodorotlenku sodu, chloru i wodoru na skalę przemysłową. Jest to bardzo ważny proces w przemyśle chemicznym.
4. Reakcja soli metali z wodorotlenkami
Sole metali mogą reagować z wodorotlenkami, tworząc trudno rozpuszczalne wodorotlenki metalu i rozpuszczalną sól.
Przykład:
FeCl3(aq) + 3NaOH(aq) → Fe(OH)3(s) + 3NaCl(aq)
W tej reakcji chlorek żelaza(III) (FeCl3) reaguje z wodorotlenkiem sodu (NaOH), tworząc wodorotlenek żelaza(III) (Fe(OH)3), który jest nierozpuszczalny i wytrąca się z roztworu, oraz chlorek sodu (NaCl), który pozostaje w roztworze.
Zastosowanie: Otrzymywanie wodorotlenków metali przejściowych, które są często używane jako katalizatory lub pigmenty.
Counterpoints: Czy istnieją alternatywne metody?
Oczywiście, istnienie alternatywnych metod otrzymywania wodorotlenków jest kwestią kontekstu i specyficznych potrzeb. Na przykład, w niektórych przypadkach można wykorzystać procesy biotechnologiczne lub elektrochemiczne alternatywne do klasycznej elektrolizy. Jednakże, w skali przemysłowej, metody opisane powyżej pozostają najbardziej efektywne i ekonomiczne.
Częstym argumentem przeciwko niektórym metodom (np. elektrolizie) jest ich energochłonność i wpływ na środowisko. To prawda, produkcja chemikaliów wymaga energii, ale postęp technologiczny zmierza w kierunku optymalizacji procesów, zmniejszenia zużycia energii i ograniczenia emisji szkodliwych substancji. Dodatkowo, wodorotlenki są kluczowe w procesach oczyszczania środowiska, co częściowo kompensuje ich wpływ.
Przyszłość otrzymywania wodorotlenków: Innowacje i zrównoważony rozwój
Przyszłość syntezy wodorotlenków wiąże się z poszukiwaniem bardziej zrównoważonych i przyjaznych dla środowiska metod. Obecnie prowadzone są badania nad:
- Wykorzystaniem odnawialnych źródeł energii (np. energia słoneczna, wiatrowa) do zasilania procesów elektrolizy.
- Opracowywaniem nowych katalizatorów, które zwiększają efektywność reakcji i zmniejszają zużycie energii.
- Poszukiwaniem alternatywnych surowców do produkcji wodorotlenków, np. wykorzystanie odpadów przemysłowych.
- Optymalizacją procesów w celu minimalizacji powstawania odpadów i emisji.
Innowacje w tej dziedzinie mają potencjał, aby znacząco zmniejszyć negatywny wpływ przemysłu chemicznego na środowisko i przyczynić się do zrównoważonego rozwoju.
Podsumowanie
Otrzymywanie wodorotlenków to proces o ogromnym znaczeniu dla wielu gałęzi przemysłu i naszego codziennego życia. Poznanie podstawowych metod otrzymywania tych związków pozwala lepiej zrozumieć procesy zachodzące wokół nas oraz docenić rolę chemii w kształtowaniu nowoczesnego świata. Od reakcji metali z wodą po zaawansowane procesy elektrolizy, każda metoda ma swoje zalety i ograniczenia. Rosnąca świadomość ekologiczna wymusza poszukiwanie bardziej zrównoważonych i efektywnych sposobów syntezy wodorotlenków, co stanowi wyzwanie dla naukowców i inżynierów.
Mamy nadzieję, że ten artykuł przybliżył Ci temat otrzymywania wodorotlenków i pokazał, jak ważna jest ta dziedzina chemii. Czy po przeczytaniu tego artykułu zastanawiasz się, jakie inne substancje chemiczne mają wpływ na Twoje codzienne życie i jak są produkowane? A może zainspiruje Cię to do zgłębienia wiedzy z zakresu chemii?