Określ Jakie Orbitale Są Opisywane Przez Podane Liczby Kwantowe

Liczby kwantowe to zestaw liczb, które opisują stan kwantowy elektronu w atomie, w tym jego energię, kształt przestrzenny orbitalu i orientację przestrzenną. Każdy orbital atomowy charakteryzuje się unikalnym zestawem tych liczb, co pozwala na precyzyjne określenie jego właściwości.
Główna liczba kwantowa (n) determinuje poziom energetyczny elektronu i rozmiar orbitalu. Przyjmuje wartości całkowite dodatnie: 1, 2, 3, i tak dalej. Wyższa wartość 'n' oznacza wyższy poziom energetyczny i większy rozmiar orbitalu. Dla n=1 mamy powłokę K, dla n=2 powłokę L, dla n=3 powłokę M, i tak dalej.
Poboczna liczba kwantowa (l), zwana również liczbą kwantową orbitalnego momentu pędu, określa kształt orbitalu. Przyjmuje wartości od 0 do n-1. l=0 odpowiada orbitalowi s (kulistemu), l=1 odpowiada orbitalowi p (kształt hantli), l=2 odpowiada orbitalowi d (bardziej skomplikowane kształty), a l=3 odpowiada orbitalowi f (jeszcze bardziej skomplikowane kształty). Wraz ze wzrostem 'l', kształt orbitalu staje się bardziej złożony.
Magnetyczna liczba kwantowa (ml) opisuje orientację przestrzenną orbitalu. Przyjmuje wartości od -l do +l, włącznie z zerem. Dla l=0 (orbital s) mamy tylko ml=0, co oznacza jedną możliwą orientację przestrzenną. Dla l=1 (orbital p) mamy ml=-1, 0, +1, co odpowiada trzem różnym orientacjom w przestrzeni (px, py, pz). Dla l=2 (orbital d) mamy ml=-2, -1, 0, +1, +2, co odpowiada pięciu różnym orientacjom.
Spinowa liczba kwantowa (ms) opisuje własny moment pędu elektronu, zwany spinem. Elektron zachowuje się jakby wirował wokół własnej osi, generując moment magnetyczny. Przyjmuje tylko dwie wartości: +1/2 (spin w górę) i -1/2 (spin w dół). W każdym orbitalu mogą znajdować się maksymalnie dwa elektrony, z przeciwnymi spinami (zgodnie z zasadą Pauliego).
Przykłady:
-
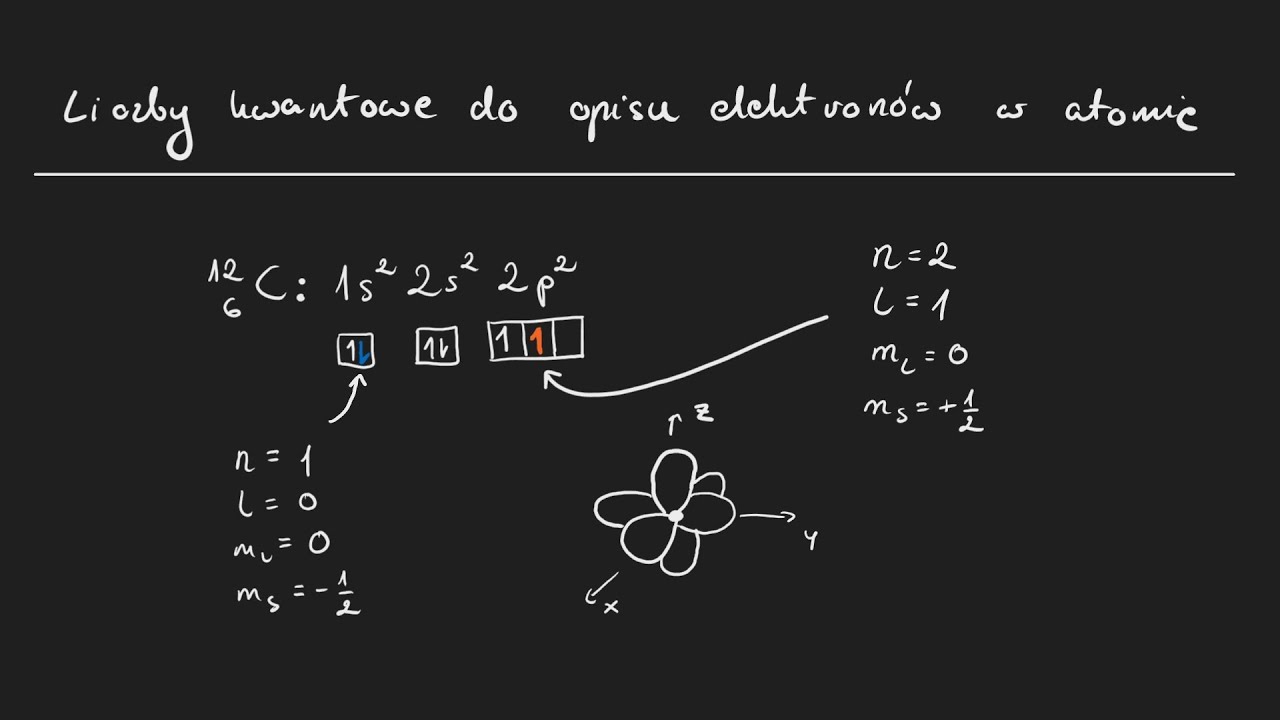
n=1, l=0, ml=0, ms=+1/2: Opisuje elektron w orbitalu 1s ze spinem w górę. Ponieważ n=1, elektron znajduje się na najniższym poziomie energetycznym. l=0 oznacza, że orbital jest kulisty (orbital s). ml=0 oznacza, że jest tylko jedna możliwa orientacja przestrzenna orbitalu s.
-
n=2, l=1, ml=-1, ms=-1/2: Opisuje elektron w orbitalu 2p ze spinem w dół. n=2 oznacza, że elektron znajduje się na drugim poziomie energetycznym. l=1 oznacza, że orbital ma kształt hantli (orbital p). ml=-1 określa konkretną orientację przestrzenną orbitalu p (np. px).
-
n=3, l=2, ml=0, ms=+1/2: Opisuje elektron w orbitalu 3d ze spinem w górę. n=3 oznacza, że elektron znajduje się na trzecim poziomie energetycznym. l=2 oznacza, że orbital ma bardziej złożony kształt (orbital d). ml=0 określa jedną z pięciu możliwych orientacji przestrzennych orbitalu d.
-
n=4, l=0, ml=0, ms=-1/2: Opisuje elektron w orbitalu 4s ze spinem w dół. n=4 oznacza, że elektron znajduje się na czwartym poziomie energetycznym. l=0 oznacza, że orbital jest kulisty (orbital s). ml=0 oznacza, że jest tylko jedna możliwa orientacja przestrzenna orbitalu s.
-
n=3, l=1, ml=+1, ms=+1/2: Opisuje elektron w orbitalu 3p ze spinem w górę. n=3 oznacza, że elektron znajduje się na trzecim poziomie energetycznym. l=1 oznacza, że orbital ma kształt hantli (orbital p). ml=+1 określa konkretną orientację przestrzenną orbitalu p (np. pz).
Omówienie dodatkowych przykładów:
Rozważmy teraz nieco bardziej szczegółowe przykłady, aby utrwalić zrozumienie związku między liczbami kwantowymi a orbitalami.
-
n=2, l=0, ml=0, ms=+1/2: Ten zestaw liczb kwantowych opisuje elektron znajdujący się w orbitalu 2s z spinem w górę. Poziom energetyczny to n=2, co oznacza, że elektron znajduje się na powłoce L. l=0 wskazuje na orbital s, który charakteryzuje się kulistym kształtem i brakiem orientacji przestrzennej (ml=0).
-
n=4, l=2, ml=-1, ms=-1/2: W tym przypadku mamy elektron w orbitalu 4d ze spinem skierowanym w dół. Elektron znajduje się na czwartym poziomie energetycznym (n=4), a wartość l=2 wskazuje na orbital d o bardziej skomplikowanym kształcie. ml=-1 określa konkretną orientację przestrzenną orbitalu d, jedną z pięciu możliwych.
-
n=5, l=1, ml=0, ms=+1/2: Ten zestaw opisuje elektron w orbitalu 5p ze spinem w górę. Elektron znajduje się na piątej powłoce (n=5), a l=1 wskazuje na orbital p o kształcie hantli. ml=0 określa orientację przestrzenną orbitalu p wzdłuż jednej z osi.
-
n=3, l=2, ml=+2, ms=-1/2: Mamy elektron w orbitalu 3d z spinem skierowanym w dół. Elektron znajduje się na trzecim poziomie energetycznym (n=3). Wartość l=2 mówi nam, że mamy do czynienia z orbitalem d. ml=+2 określa orientację przestrzenną tego orbitalu.
-
n=6, l=0, ml=0, ms=+1/2: Opisuje elektron znajdujący się w orbitalu 6s ze spinem w górę. Poziom energetyczny to n=6, co oznacza, że elektron znajduje się na powłoce N. l=0 wskazuje na orbital s, który charakteryzuje się kulistym kształtem i brakiem orientacji przestrzennej (ml=0).
-
n=4, l=3, ml=-2, ms=-1/2: Ten przykład odnosi się do elektronu w orbitalu 4f ze spinem skierowanym w dół. Elektron znajduje się na czwartym poziomie energetycznym (n=4). Wartość l=3 odpowiada orbitalowi f, który ma bardzo skomplikowany kształt. ml=-2 określa konkretną orientację przestrzenną orbitalu f.
-
n=5, l=2, ml=+1, ms=+1/2: Opisuje elektron w orbitalu 5d ze spinem w górę. n=5 oznacza piątą powłokę. l=2 oznacza orbital d, a ml=+1 opisuje jego specyficzną orientację przestrzenną.
-
n=3, l=0, ml=0, ms=-1/2: Reprezentuje elektron w orbitalu 3s o spinie w dół. Jest to orbital s na trzeciej powłoce elektronowej.
H2 Analiza możliwości wystąpienia kombinacji liczb kwantowych
Ważne jest, aby pamiętać, że nie wszystkie kombinacje liczb kwantowych są dozwolone. Zawsze należy upewnić się, że wartości liczb kwantowych spełniają następujące warunki:
- n musi być liczbą całkowitą dodatnią (1, 2, 3, ...).
- l musi być liczbą całkowitą z zakresu od 0 do n-1.
- ml musi być liczbą całkowitą z zakresu od -l do +l.
- ms musi być równe +1/2 lub -1/2.
Przyjrzyjmy się kilku przykładom niedozwolonych kombinacji:
-
n=2, l=2, ml=0, ms=+1/2: Niedozwolone, ponieważ l nie może być równe n. l musi być mniejsze od n. Maksymalna wartość l dla n=2 to l=1.
-
n=3, l=1, ml=-2, ms=-1/2: Niedozwolone, ponieważ ml musi mieścić się w zakresie od -l do +l. Dla l=1, ml może przyjmować wartości -1, 0 lub +1.
-
n=1, l=0, ml=1, ms=+1/2: Niedozwolone, ponieważ dla l=0, ml może przyjmować tylko wartość 0.
Znajomość tych zasad pozwala na prawidłowe identyfikowanie orbitali opisywanych przez zestawy liczb kwantowych i unikanie błędów w opisie struktury elektronowej atomów.
Zatem, analizując dany zestaw liczb kwantowych, zawsze należy zweryfikować, czy spełnia on powyższe warunki, aby móc jednoznacznie i poprawnie określić, jaki orbital jest opisywany. Prawidłowa interpretacja liczb kwantowych jest kluczowa dla zrozumienia właściwości chemicznych pierwiastków i ich zdolności do tworzenia wiązań chemicznych.
H2 Zastosowanie w Chemii
Zrozumienie liczb kwantowych i ich związku z orbitalami jest fundamentem do zrozumienia koncepcji konfiguracji elektronowej atomów, a ta z kolei ma kluczowe znaczenie dla przewidywania właściwości chemicznych pierwiastków, ich reaktywności oraz rodzaju wiązań, które mogą tworzyć. Na przykład, atomy z niepełnymi powłokami walencyjnymi (ostatnią powłoką elektronową) są bardziej skłonne do tworzenia wiązań, aby osiągnąć stabilną konfigurację elektronową (np. oktet w przypadku pierwiastków bloku p).
H2 Podsumowanie
Podsumowując, liczby kwantowe (n, l, ml, ms) dostarczają kompletną informację o stanie elektronu w atomie, określając jego energię, kształt i orientację przestrzenną orbitalu, a także spin. Umiejętność interpretacji liczb kwantowych i przypisywania ich odpowiednim orbitalom jest kluczowa dla zrozumienia struktury atomowej i molekularnej oraz właściwości chemicznych pierwiastków. Pamiętanie o ograniczeniach dotyczących dozwolonych wartości liczb kwantowych jest niezbędne do unikania błędów w opisie stanów elektronowych.