Odpowiedzi Z Chemii Sprawdzian Układ Okresowy

Witaj! Chcesz lepiej zrozumieć chemię, a konkretnie układ okresowy pierwiastków? Świetnie trafiłeś! Ten przewodnik pomoże Ci ogarnąć najważniejsze zagadnienia związane z układem okresowym, przygotować się do sprawdzianu i zrozumieć, jak wiedza o nim przydaje się w życiu.
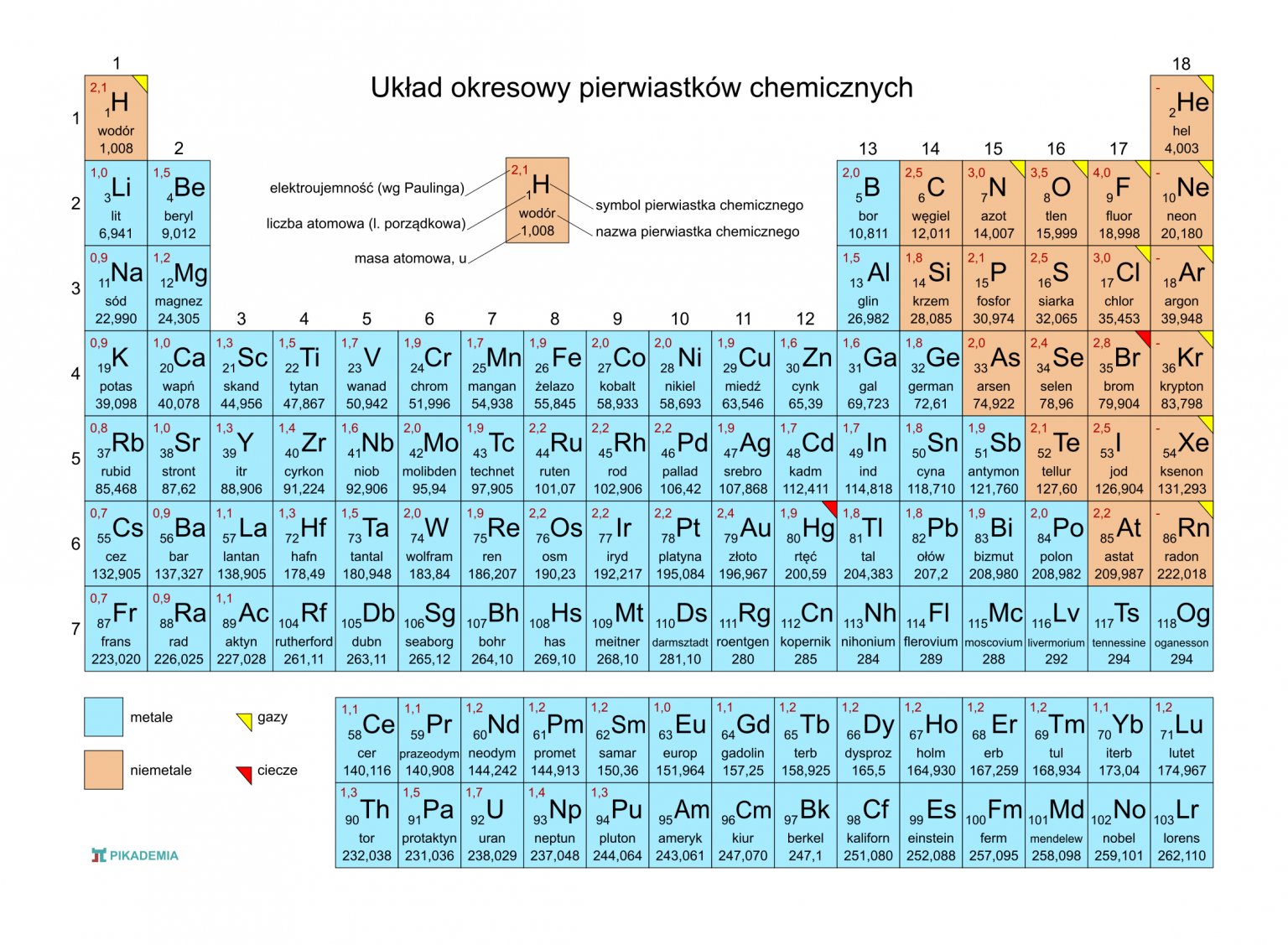
Czym jest układ okresowy?
Najważniejsze, żebyś wiedział, czym tak naprawdę jest układ okresowy. Najprościej mówiąc, to tabelaryczne zestawienie wszystkich znanych pierwiastków chemicznych, ułożonych według rosnącej liczby atomowej (czyli liczby protonów w jądrze atomowym). To taka chemiczna mapa, która pokazuje, jak poszczególne pierwiastki są ze sobą powiązane i jakie mają właściwości.
Budowa układu okresowego
Układ okresowy składa się z okresów (poziomych rzędów) i grup (pionowych kolumn). Okresy numerowane są od 1 do 7. Numer okresu mówi nam o tym, ile powłok elektronowych ma atom pierwiastka w danym okresie. Na przykład, sód (Na) znajduje się w trzecim okresie, więc ma trzy powłoki elektronowe.
Grupy są numerowane od 1 do 18. Pierwiastki w tej samej grupie mają podobne właściwości chemiczne, ponieważ mają tę samą liczbę elektronów walencyjnych (czyli elektronów na ostatniej powłoce). Przykładowo, fluor (F) i chlor (Cl) należą do 17. grupy (halogenów) i oba są bardzo reaktywne.
Główne grupy pierwiastków
Warto znać nazwy kilku ważnych grup pierwiastków:
- Metale alkaliczne (grupa 1, np. sód, potas) - bardzo reaktywne, łatwo oddają elektron.
- Metale ziem alkalicznych (grupa 2, np. magnez, wapń) - mniej reaktywne niż metale alkaliczne.
- Halogeny (grupa 17, np. fluor, chlor) - bardzo reaktywne, łatwo przyjmują elektron.
- Gazy szlachetne (grupa 18, np. hel, neon) - bardzo niereaktywne, mają pełną powłokę elektronową.
Elektroujemność i charakter metaliczny
Ważne pojęcia to elektroujemność i charakter metaliczny. Elektroujemność to miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym. W układzie okresowym elektroujemność rośnie od lewej do prawej i od dołu do góry. Charakter metaliczny to tendencja pierwiastka do oddawania elektronów. Rośnie od prawej do lewej i od góry do dołu. Dzięki znajomości tych trendów, możesz przewidywać właściwości pierwiastków i związków chemicznych.
Jak wykorzystać wiedzę o układzie okresowym w życiu?
Wiedza o układzie okresowym nie jest tylko teorią. Pomaga zrozumieć świat wokół nas. Na przykład, dlaczego niektóre metale korodują (żelazo), a inne nie (złoto)? Dlatego, że żelazo jest bardziej reaktywne (ma mniejszą elektroujemność) niż złoto i łatwiej wchodzi w reakcje z tlenem z powietrza. Układ okresowy jest też kluczowy w medycynie (np. rola pierwiastków śladowych w organizmie), technologii (np. dobór materiałów do elektroniki) i rolnictwie (np. nawozy).
Mam nadzieję, że ten przewodnik pomógł Ci lepiej zrozumieć układ okresowy pierwiastków. Powodzenia na sprawdzianie!