Napisz Wzór Sumaryczny I Strukturalny Kwasu Chlorowodorowego
Kwas chlorowodorowy, powszechnie znany jako kwas solny, jest jednym z najważniejszych i najbardziej powszechnych kwasów nieorganicznych. Jego szerokie zastosowanie w przemyśle, laboratoriach i wielu innych dziedzinach życia sprawia, że zrozumienie jego budowy i właściwości jest kluczowe.
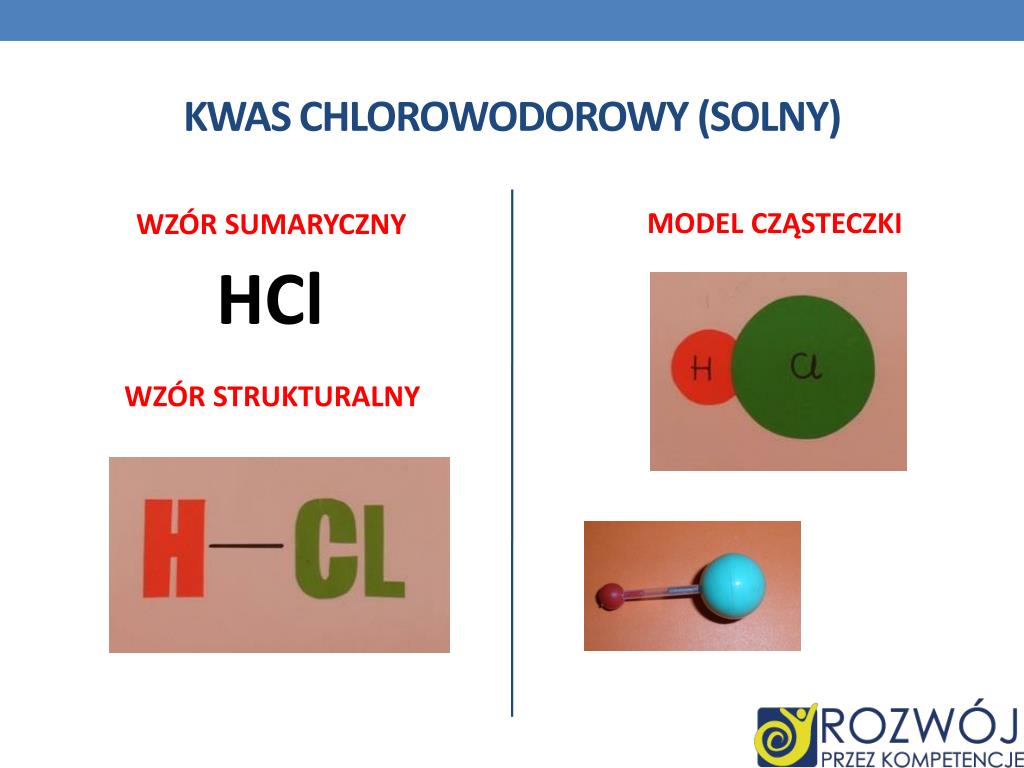
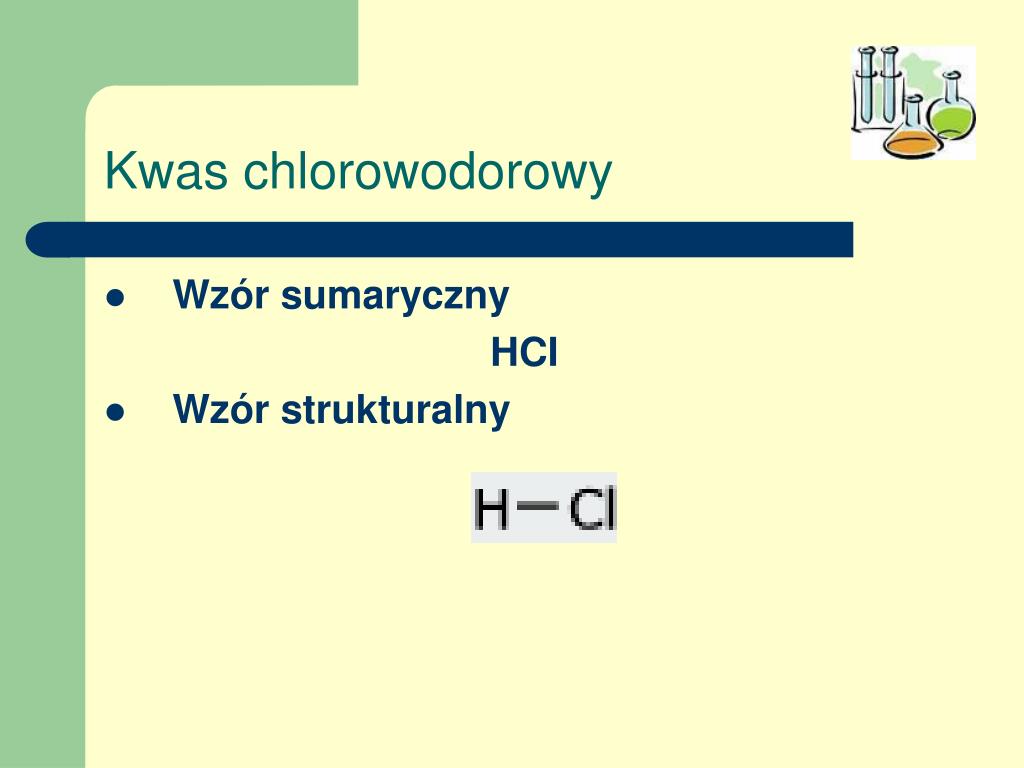
Wzór sumaryczny kwasu chlorowodorowego to HCl. Jest to proste wyrażenie, informujące nas o tym, że w cząsteczce kwasu chlorowodorowego występuje jeden atom wodoru (H) i jeden atom chloru (Cl). Wzór sumaryczny nie mówi nam jednak nic o sposobie, w jaki te atomy są ze sobą połączone.
Aby to zobrazować, potrzebujemy wzoru strukturalnego. Wzór strukturalny kwasu chlorowodorowego to H-Cl. Ta krótka kreska pomiędzy symbolem wodoru (H) a symbolem chloru (Cl) oznacza wiązanie kowalencyjne pojedyncze. Wiązanie kowalencyjne polega na uwspólnieniu pary elektronów pomiędzy dwoma atomami. W przypadku kwasu chlorowodorowego, atom wodoru oddaje jeden elektron, a atom chloru również jeden elektron, tworząc wspólną parę elektronową, która utrzymuje oba atomy razem.
Kwas chlorowodorowy w czystej postaci, czyli chlorowodór (HCl) jest bezbarwnym gazem o ostrym, drażniącym zapachu. Jest bardzo dobrze rozpuszczalny w wodzie. Rozpuszczanie chlorowodoru w wodzie prowadzi do powstania roztworu kwasu chlorowodorowego, który jest mocnym kwasem. To właśnie ten roztwór jest powszechnie używany w laboratoriach i przemyśle.
Proces rozpuszczania chlorowodoru w wodzie jest egzotermiczny, co oznacza, że podczas rozpuszczania uwalniane jest ciepło. Roztwór kwasu chlorowodorowego wykazuje silne właściwości korozyjne. Oznacza to, że reaguje z wieloma metalami, powodując ich rozpuszczanie i tworzenie chlorków.
Reakcja kwasu chlorowodorowego z metalem możemy zapisać ogólnie jako:
Metal + HCl → Chlorek metalu + H2
Na przykład, reakcja z cynkiem przebiega następująco:
Zn + 2HCl → ZnCl2 + H2
W wyniku tej reakcji powstaje chlorek cynku i wydziela się wodór.
Kwas chlorowodorowy ma bardzo szerokie zastosowanie. W przemyśle chemicznym jest wykorzystywany do produkcji wielu różnych związków chemicznych, takich jak chlorki metali, tworzywa sztuczne, barwniki i leki. Jest również używany w procesach oczyszczania metali, trawienia stali i regulacji pH w różnych procesach przemysłowych.
W laboratoriach kwas chlorowodorowy jest powszechnie stosowany jako odczynnik analityczny, do miareczkowania, rozpuszczania próbek i przygotowywania roztworów o określonym pH.
W gospodarstwach domowych rozcieńczony kwas chlorowodorowy (często pod nazwą "kwas solny") jest stosowany do czyszczenia powierzchni, usuwania rdzy i osadów z kamienia. Należy jednak pamiętać, że praca z kwasem chlorowodorowym wymaga zachowania szczególnej ostrożności, ponieważ jest to substancja żrąca, która może powodować oparzenia skóry i uszkodzenia oczu. Zawsze należy stosować odpowiednie środki ochrony osobistej, takie jak rękawice ochronne i okulary ochronne, oraz pracować w dobrze wentylowanym pomieszczeniu.
Kwas chlorowodorowy odgrywa również ważną rolę w procesach trawiennych zachodzących w żołądku. Komórki okładzinowe błony śluzowej żołądka wytwarzają kwas chlorowodorowy, który pomaga w rozkładzie pokarmu, zabija bakterie i aktywuje enzym pepsynę, odpowiedzialną za trawienie białek.
W medycynie kwas chlorowodorowy jest wykorzystywany w leczeniu niedokwasoty żołądka, czyli stanu, w którym żołądek produkuje zbyt mało kwasu solnego. Niedokwasota może prowadzić do problemów z trawieniem, wchłanianiem składników odżywczych i zwiększonego ryzyka infekcji.
Podsumowując, kwas chlorowodorowy jest niezwykle wszechstronnym i ważnym związkiem chemicznym. Jego prosta budowa (HCl, H-Cl) kontrastuje z jego szerokim zakresem zastosowań i istotną rolą w wielu procesach przemysłowych, laboratoryjnych i biologicznych. Należy jednak pamiętać o jego właściwościach żrących i zachować ostrożność podczas pracy z nim. Zrozumienie wzoru sumarycznego i strukturalnego kwasu chlorowodorowego jest fundamentalne dla każdego, kto zajmuje się chemią, naukami pokrewnymi lub wykorzystuje go w praktyce. Znajomość jego właściwości i zastosowań pozwala na bezpieczne i efektywne wykorzystanie tego cennego związku. Ważne jest, aby pamiętać, że reakcje z kwasem chlorowodorowym mogą prowadzić do powstawania różnych produktów, w zależności od substratów. Dlatego zawsze należy dokładnie zapoznać się z zasadami bezpieczeństwa i procedurami postępowania z tą substancją. Właściwe użytkowanie kwasu chlorowodorowego jest kluczem do czerpania korzyści z jego unikalnych właściwości bez narażania się na niebezpieczeństwo.