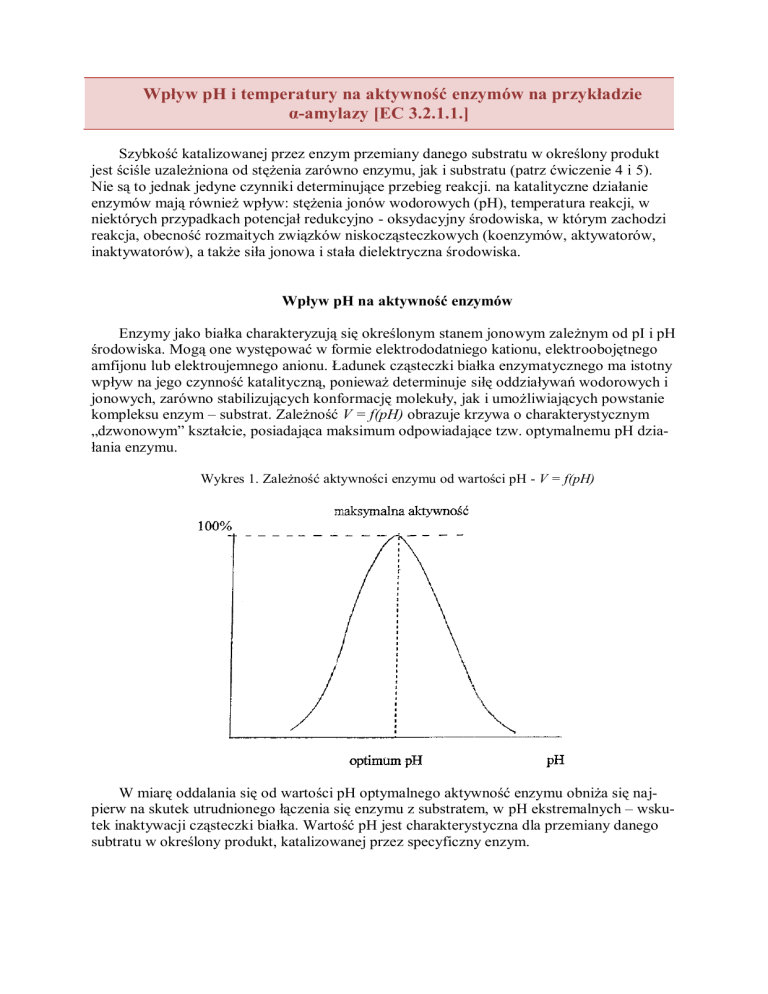
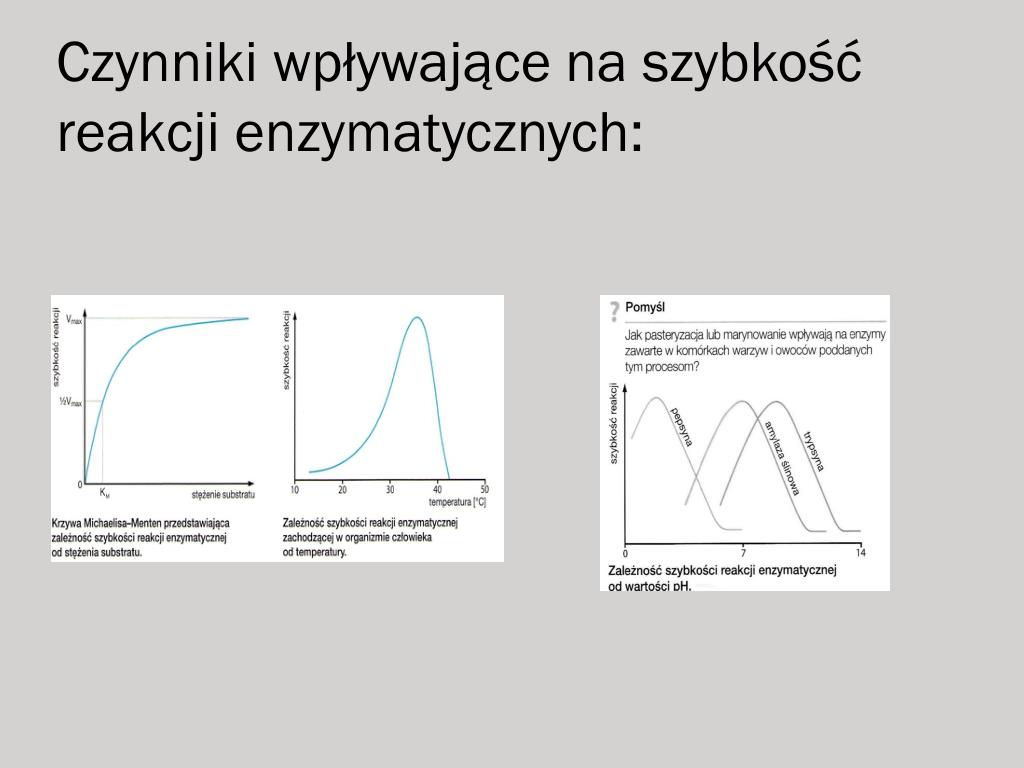
Na Wykresach Przedstawiono Wpływ Ph Na Aktywność Trzech Enzymów

Na wykresach przedstawiono wpływ pH na aktywność trzech enzymów. Przyjrzyjmy się im bliżej, analizując kształty krzywych i charakterystyczne punkty. Pozwoli to na wyciągnięcie wniosków o naturze tych enzymów i ich funkcjonowaniu w różnych środowiskach.
Enzym A wykazuje wyraźną aktywność w stosunkowo wąskim zakresie pH. Krzywa wznosi się gwałtownie, osiągając maksimum przy pH około 7. Następnie, równie szybko opada, wskazując na utratę aktywności poza tym optymalnym zakresem. Możemy zatem wnioskować, że enzym A preferuje środowisko neutralne. Zmiana pH, nawet niewielka, w kierunku kwaśnym lub zasadowym, drastycznie zmniejsza jego efektywność.
Enzym B prezentuje odmienny profil. Jego aktywność rośnie stopniowo wraz ze wzrostem pH, osiągając plateau przy pH około 9. Dalszy wzrost pH nie powoduje znaczącej zmiany aktywności. Oznacza to, że enzym B jest stabilny i funkcjonalny w środowisku zasadowym. Nie wykazuje gwałtownego spadku aktywności jak enzym A, co sugeruje większą tolerancję na zmiany pH, przynajmniej w zakresie zasadowym. Aktywność enzymu B przy niskim pH jest minimalna, co dodatkowo potwierdza jego preferencje dotyczące środowiska zasadowego.
Enzym C charakteryzuje się najwyższą aktywnością w środowisku kwaśnym. Jego krzywa wykazuje maksimum przy pH około 3. Wraz ze wzrostem pH, aktywność enzymu C stopniowo maleje. Przy pH zbliżonym do neutralnego, aktywność jest już bardzo niska. To wskazuje, że enzym C jest przystosowany do funkcjonowania w środowisku o wysokiej kwasowości. Przeniesienie go do środowiska o wyższym pH skutkuje dezaktywacją.
Analiza Porównawcza Aktywności Enzymów w Zależności od pH
Porównując trzy enzymy, widzimy wyraźne różnice w ich wrażliwości na pH. Enzym A jest najbardziej wrażliwy, działający optymalnie w wąskim zakresie neutralnym. Enzym B preferuje środowisko zasadowe, wykazując stabilną aktywność w tym zakresie. Enzym C natomiast jest enzymem kwaśnym, którego aktywność maleje wraz ze wzrostem pH.
Różnice te wynikają z budowy przestrzennej enzymów, a konkretnie z obecności grup funkcyjnych w centrum aktywnym i na powierzchni białka. Zmiana pH wpływa na stan jonizacji tych grup, co może prowadzić do zmiany konformacji białka i utraty jego zdolności do wiązania substratu.
W przypadku enzymu A, niewielka zmiana pH może zakłócić strukturę centrum aktywnego, uniemożliwiając wiązanie substratu i przeprowadzenie reakcji. Enzym B, działający w środowisku zasadowym, posiada grupy funkcyjne przystosowane do takiego środowiska. Zmiana pH w kierunku kwaśnym powoduje protonowanie tych grup, co zmienia strukturę białka i zmniejsza jego aktywność. Podobnie, enzym C, działający w środowisku kwaśnym, posiada grupy funkcyjne, które w tym środowisku są w optymalnym stanie jonizacji. Wzrost pH prowadzi do deprotonacji tych grup, co zmienia strukturę białka i zmniejsza jego aktywność.
Zależność aktywności enzymów od pH ma ogromne znaczenie biologiczne. Pozwala komórkom na regulowanie procesów metabolicznych poprzez zmianę pH środowiska. Przykładowo, w żołądku, gdzie panuje bardzo kwaśne środowisko, aktywne są enzymy trawienne przystosowane do takiego pH, takie jak pepsyna. W jelicie cienkim, gdzie pH jest bardziej zasadowe, aktywne są inne enzymy, takie jak trypsyna i chymotrypsyna.
Optymalne pH dla danego enzymu jest ściśle związane z miejscem jego występowania i funkcją, jaką pełni w organizmie. Analiza wykresów przedstawiających wpływ pH na aktywność enzymów pozwala na zrozumienie mechanizmów regulacji procesów metabolicznych i adaptacji organizmów do różnych warunków środowiskowych. Ponadto, informacje te mają znaczenie w biotechnologii i przemyśle, gdzie enzymy są wykorzystywane w różnych procesach, takich jak produkcja żywności, leków i detergentów. Ważne jest, aby dobrać odpowiedni enzym do danego procesu, biorąc pod uwagę optymalne pH dla jego aktywności.
Kształt krzywej zależności aktywności enzymu od pH może również dostarczyć informacji o mechanizmie reakcji enzymatycznej. Na przykład, ostre maksimum, jak w przypadku enzymu A, sugeruje, że zmiana pH wpływa na kluczowe etapy reakcji, takie jak wiązanie substratu lub tworzenie produktu. Natomiast, plateau, jak w przypadku enzymu B, sugeruje, że aktywność enzymu jest mniej wrażliwa na zmiany pH w danym zakresie.
Warto również zauważyć, że w niektórych przypadkach, aktywność enzymu może być modulowana przez inne czynniki, takie jak obecność jonów metali, temperatura i stężenie substratu. Czynniki te mogą wpływać na strukturę białka i jego zdolność do wiązania substratu, co z kolei wpływa na jego aktywność.
Podsumowując, analiza wykresów przedstawiających wpływ pH na aktywność enzymów dostarcza cennych informacji o ich właściwościach i funkcjonowaniu. Pozwala na zrozumienie mechanizmów regulacji procesów metabolicznych i adaptacji organizmów do różnych warunków środowiskowych. Informacje te mają również znaczenie w biotechnologii i przemyśle, gdzie enzymy są wykorzystywane w różnych procesach. Zrozumienie zależności aktywności enzymów od pH jest kluczowe dla wykorzystania ich potencjału w różnych dziedzinach nauki i technologii.