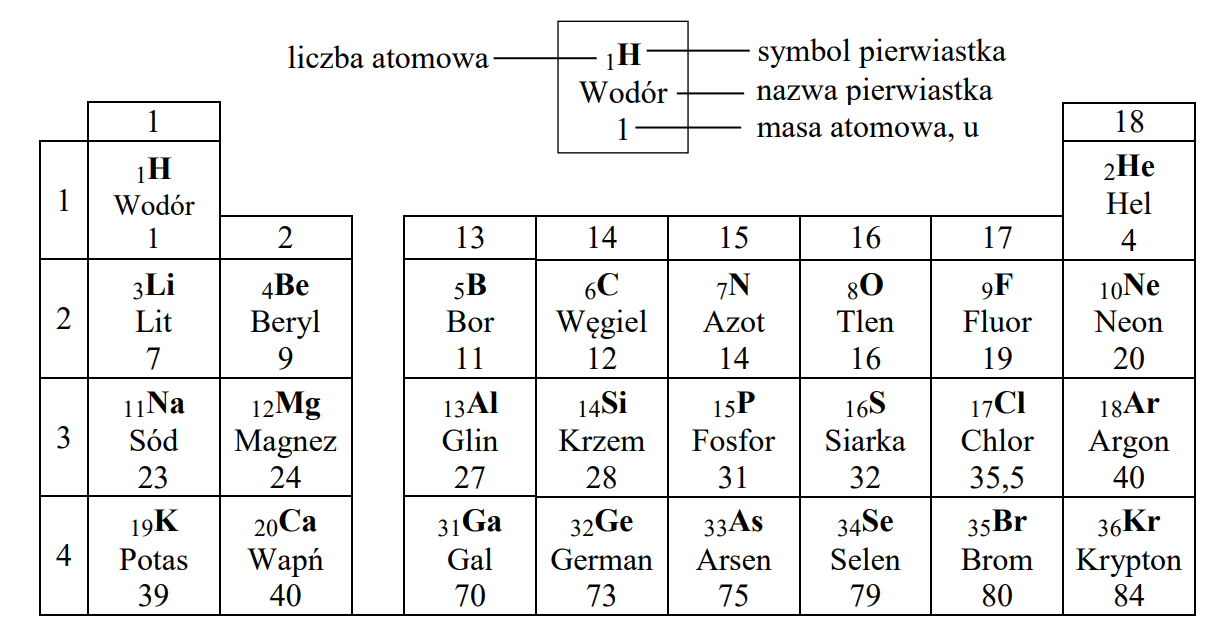
Na Którym Rysunku Przedstawiono Modele Atomów Różnych Pierwiastków

Drodzy Uczniowie,
Wasze pytania dotyczące identyfikacji modeli atomów różnych pierwiastków na rysunkach są niezwykle istotne dla zrozumienia podstaw chemii. Przyjrzyjmy się temu zagadnieniu dogłębnie, wykorzystując moją wiedzę i doświadczenie w tej dziedzinie.
Aby rozpoznać, czy rysunek przedstawia modele atomów różnych pierwiastków, musimy skupić się na kilku kluczowych aspektach. Przede wszystkim, analizujemy liczbę protonów w jądrze każdego atomu. Liczba protonów, zwana liczbą atomową (Z), jest unikalna dla każdego pierwiastka. To ona definiuje, jaki to pierwiastek. Zatem, jeśli na rysunku widzimy atomy z różną liczbą protonów w jądrach, możemy z całą pewnością stwierdzić, że przedstawiają one różne pierwiastki.
Zwróćcie uwagę na sposób, w jaki protony są reprezentowane na rysunku. Zazwyczaj są one oznaczane jako cząstki z ładunkiem dodatnim (+). Policzcie je dokładnie w każdym atomie. Przykładowo, atom z jednym protonem to zawsze atom wodoru, atom z sześcioma protonami to atom węgla, a atom z ośmioma protonami to atom tlenu. Różnice w tej liczbie od razu wskazują na różne pierwiastki.
Kolejnym aspektem jest analiza liczby elektronów otaczających jądro atomu. W neutralnym atomie, liczba elektronów jest równa liczbie protonów. Elektrony mają ładunek ujemny (-) i krążą wokół jądra na różnych poziomach energetycznych, zwanych powłokami elektronowymi. Liczba elektronów na poszczególnych powłokach również wpływa na właściwości chemiczne pierwiastka, ale to liczba protonów w jądrze jest kluczowa dla identyfikacji.
Spójrzcie na konfigurację elektronową atomów na rysunku. Pamiętajcie o zasadach obsadzania powłok elektronowych. Pierwsza powłoka (K) może pomieścić maksymalnie 2 elektrony, druga (L) maksymalnie 8 elektronów, a trzecia (M) maksymalnie 18 elektronów. Zwróćcie uwagę, czy atomy na rysunku spełniają te zasady. Chociaż konfiguracja elektronowa jest ważna dla określenia właściwości chemicznych, to różnica w liczbie protonów jest definitywnym dowodem na to, że mamy do czynienia z różnymi pierwiastkami.
W niektórych przypadkach rysunki mogą przedstawiać jony, czyli atomy, które utraciły lub zyskały elektrony. Jony dodatnie (kationy) mają mniej elektronów niż protonów, a jony ujemne (aniony) mają więcej elektronów niż protonów. Nawet jeśli atomy na rysunku mają różną liczbę elektronów, ale tę samą liczbę protonów, to nadal są to atomy tego samego pierwiastka, tylko w postaci jonów.
Również obecność izotopów może wprowadzać pewne zamieszanie. Izotopy to atomy tego samego pierwiastka, które mają różną liczbę neutronów w jądrze. Neutrony są cząstkami obojętnymi elektrycznie i znajdują się w jądrze atomu wraz z protonami. Liczba neutronów wpływa na masę atomową, ale nie zmienia jego tożsamości jako pierwiastka. Dlatego, jeśli na rysunku widzimy atomy z tą samą liczbą protonów, ale różną liczbą neutronów, to są to izotopy tego samego pierwiastka.
Analiza Rysunków z Modelami Atomów
Skupmy się teraz na praktycznej analizie rysunków. Załóżmy, że mamy rysunek przedstawiający dwa modele atomów. Pierwszy atom ma 6 protonów i 6 elektronów, a drugi atom ma 8 protonów i 8 elektronów.
Atom z 6 protonami to atom węgla (C), ponieważ liczba atomowa węgla wynosi 6. Atom z 8 protonami to atom tlenu (O), ponieważ liczba atomowa tlenu wynosi 8. Zatem, ten rysunek przedstawia modele atomów różnych pierwiastków, konkretnie węgla i tlenu.
Inny przykład: rysunek przedstawia dwa atomy. Pierwszy atom ma 1 proton i 1 elektron, a drugi atom ma 1 proton i 0 elektronów.
Oba atomy mają 1 proton, co oznacza, że są to atomy wodoru (H). Jednak drugi atom stracił jeden elektron i stał się jonem dodatnim (kationem) o ładunku +1. Zatem, ten rysunek przedstawia atom wodoru i jon wodoru, czyli nadal wariacje tego samego pierwiastka.
Jeszcze jeden przykład: rysunek przedstawia dwa atomy. Pierwszy atom ma 17 protonów i 17 elektronów, a drugi atom ma 17 protonów i 18 elektronów.
Oba atomy mają 17 protonów, co oznacza, że są to atomy chloru (Cl). Jednak drugi atom zyskał jeden elektron i stał się jonem ujemnym (anionem) o ładunku -1. Zatem, ten rysunek przedstawia atom chloru i jon chlorkowy, czyli nadal wariacje tego samego pierwiastka.
Pamiętajcie, że kluczem do identyfikacji jest liczba protonów. Jeśli liczba protonów jest różna, mamy do czynienia z różnymi pierwiastkami. Różnice w liczbie elektronów oznaczają, że mamy do czynienia z jonami, a różnice w liczbie neutronów oznaczają, że mamy do czynienia z izotopami.
Dodatkowe Wskazówki i Szczegóły
Oprócz analizy liczby protonów, elektronów i neutronów, warto również zwrócić uwagę na sposób przedstawienia atomów na rysunku. Często modele atomów są przedstawiane w sposób uproszczony, z jądrem w centrum i elektronami krążącymi wokół niego na powłokach. Czasami powłoki elektronowe są przedstawiane jako okręgi, a czasami jako bardziej abstrakcyjne reprezentacje przestrzenne.
Upewnijcie się, że rozumiecie, co oznaczają poszczególne symbole i oznaczenia na rysunku. Na przykład, protony mogą być oznaczane jako kółka z plusem (+), neutrony jako kółka bez ładunku, a elektrony jako kółka z minusem (-). Ważne jest, aby dokładnie rozróżniać te symbole, aby móc poprawnie policzyć liczbę poszczególnych cząstek w atomie.
W niektórych przypadkach rysunki mogą przedstawiać modele atomów w kontekście cząsteczek chemicznych. W takim przypadku należy zwrócić uwagę na sposób, w jaki atomy są połączone ze sobą. Atomy różnych pierwiastków mogą łączyć się ze sobą poprzez wiązania chemiczne, tworząc cząsteczki. Na przykład, cząsteczka wody (H2O) składa się z dwóch atomów wodoru i jednego atomu tlenu.
Pamiętajcie, że zrozumienie struktury atomu jest kluczowe dla zrozumienia chemii jako całości. Im lepiej zrozumiecie budowę atomu, tym łatwiej będzie Wam zrozumieć właściwości chemiczne pierwiastków i związków chemicznych. Zatem, poświęćcie czas na dokładne przestudiowanie tego zagadnienia i zadawajcie pytania, jeśli coś jest niejasne.
Mam nadzieję, że moje wyjaśnienia pomogą Wam w identyfikacji modeli atomów różnych pierwiastków na rysunkach. Pamiętajcie o analizie liczby protonów, elektronów i neutronów, oraz o zwracaniu uwagi na sposób przedstawienia atomów na rysunku. Powodzenia w dalszej nauce chemii!