Metody Otrzymywania Wodorotlenków

Zastanawiałeś się kiedyś, jak powstają substancje, które tak często otaczają nas w życiu codziennym? Od detergentów po leki – wodorotlenki są kluczowymi składnikami wielu z nich. Proces ich otrzymywania, choć na pozór skomplikowany, w rzeczywistości opiera się na kilku fundamentalnych metodach chemicznych. W tym artykule przyjrzymy się im bliżej, tak abyś zrozumiał, jak tworzy się te niezwykle przydatne związki.
Zrozumienie metod otrzymywania wodorotlenków jest ważne nie tylko dla chemików, ale także dla każdego, kto interesuje się światem nauki i technologią. W końcu, wodorotlenki są obecne w wielu procesach przemysłowych i mają kluczowe znaczenie dla naszego codziennego funkcjonowania. Przejdźmy więc do konkretów!
Metody Otrzymywania Wodorotlenków
Istnieje kilka głównych sposobów na uzyskanie wodorotlenków. Każda z metod ma swoje specyficzne zastosowania i ograniczenia, a wybór konkretnej zależy od rodzaju wodorotlenku, jaki chcemy otrzymać, oraz od dostępnych surowców i technologii.
1. Reakcja Metali Aktywnych z Wodą
To jedna z najprostszych i najbardziej bezpośrednich metod. Metale aktywne, takie jak lit (Li), sód (Na), potas (K), rubid (Rb) i cez (Cs) reagują burzliwie z wodą, tworząc wodorotlenek danego metalu i wodór (H2).
Równanie ogólne reakcji:
2M + 2H2O → 2MOH + H2
Gdzie M oznacza metal alkaliczny.
Przykład: Reakcja sodu z wodą:
2Na + 2H2O → 2NaOH + H2
Ważne: Ta reakcja jest egzotermiczna, co oznacza, że wydziela się ciepło. W przypadku potasu, rubidu i cezu reakcja może być na tyle gwałtowna, że zapali wydzielający się wodór, prowadząc do eksplozji. Dlatego należy zachować szczególną ostrożność podczas przeprowadzania tego eksperymentu.
Zastosowanie: Otrzymywanie wodorotlenku sodu (NaOH), zwanego potocznie ługiem sodowym, na skalę laboratoryjną. Na skalę przemysłową stosuje się inne metody.
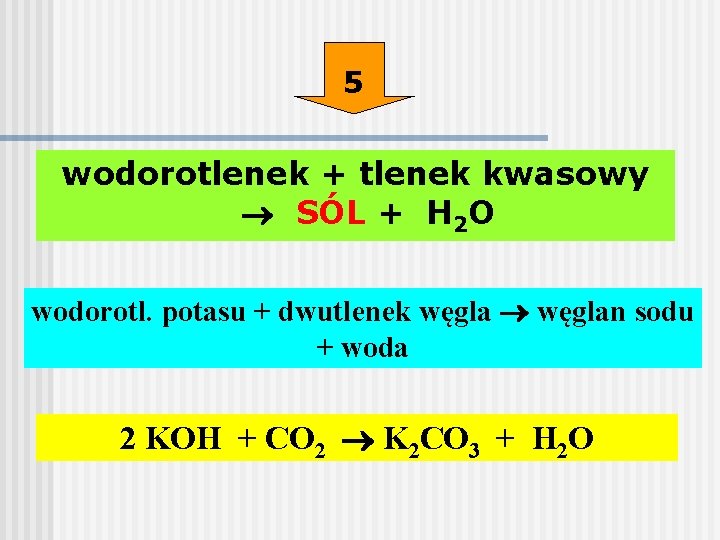
2. Reakcja Tlenków Metali z Wodą
Tlenki metali alkalicznych i metali ziem alkalicznych reagują z wodą, tworząc odpowiednie wodorotlenki. Ta metoda jest mniej gwałtowna niż reakcja metali z wodą.
Równanie ogólne reakcji:
MxOy + yH2O → xM(OH)2y/x
Przykład: Reakcja tlenku wapnia (CaO), znanego jako wapno palone, z wodą:
CaO + H2O → Ca(OH)2
Produktem jest wodorotlenek wapnia, znany jako wapno gaszone.
Zastosowanie: Otrzymywanie wodorotlenku wapnia (Ca(OH)2), który znajduje szerokie zastosowanie w budownictwie (zaprawy murarskie), rolnictwie (regulacja kwasowości gleby) i przemyśle spożywczym.
3. Elektroliza Roztworów Soli
Elektroliza roztworów soli metali alkalicznych, takich jak chlorek sodu (NaCl), jest ważną metodą przemysłową otrzymywania wodorotlenków. Podczas elektrolizy, na katodzie wydziela się wodór, a wokół katody gromadzą się jony wodorotlenkowe (OH-), tworząc roztwór wodorotlenku.
Równanie reakcji (dla elektrolizy roztworu NaCl):
2NaCl + 2H2O → 2NaOH + Cl2 + H2
Produktami są wodorotlenek sodu (NaOH), chlor (Cl2) i wodór (H2).
Ważne: W procesie elektrolizy konieczne jest oddzielenie wodorotlenku sodu od chloru, aby zapobiec ich reakcji. Stosuje się różne metody, takie jak diaphragmy lub membrany jonowymienne.
Zastosowanie: Przemysłowa produkcja wodorotlenku sodu (NaOH), który jest jednym z najważniejszych surowców w przemyśle chemicznym. Używany jest m.in. do produkcji mydeł, detergentów, papieru, włókien sztucznych i wielu innych produktów.
4. Reakcja Soli Metali z Wodorotlenkami
Wodorotlenki metali mniej aktywnych, takich jak żelazo (Fe) czy miedź (Cu), można otrzymać przez reakcję roztworów ich soli z roztworami wodorotlenków metali alkalicznych. W wyniku tej reakcji powstaje trudno rozpuszczalny wodorotlenek danego metalu, który wydziela się w postaci osadu.
Równanie ogólne reakcji:
Mn+(aq) + nOH-(aq) → M(OH)n(s)
Gdzie M oznacza metal, n to jego wartościowość, (aq) oznacza roztwór wodny, a (s) oznacza osad.
Przykład: Reakcja chlorku żelaza(III) (FeCl3) z wodorotlenkiem sodu (NaOH):
FeCl3(aq) + 3NaOH(aq) → Fe(OH)3(s) + 3NaCl(aq)
Produktem jest osad wodorotlenku żelaza(III) (Fe(OH)3).
Ważne: Rozpuszczalność wodorotlenków metali jest zwykle niska. Wyjątkiem są wodorotlenki metali alkalicznych, które są dobrze rozpuszczalne w wodzie.
Zastosowanie: Otrzymywanie wodorotlenków metali przejściowych, które znajdują zastosowanie jako pigmenty (np. wodorotlenek żelaza(III) jako pigment rdzawo-brązowy), katalizatory i półprodukty w syntezie chemicznej.
5. Specjalne Metody Otrzymywania Wodorotlenków
Oprócz wymienionych powyżej metod ogólnych, istnieją również specjalne metody, dostosowane do otrzymywania konkretnych wodorotlenków. Na przykład, wodorotlenek amonu (NH4OH), zwany potocznie wodą amoniakalną, powstaje przez rozpuszczenie amoniaku (NH3) w wodzie:
NH3(g) + H2O(l) ⇌ NH4OH(aq)
Wodorotlenek amonu jest słabą zasadą i występuje tylko w roztworze. Jest używany jako środek czyszczący, odczynnik laboratoryjny i nawóz.
Inne specjalne metody mogą obejmować reakcje elektrochemiczne w specyficznych warunkach, użycie kompleksów metali lub inne niestandardowe podejścia.
Podsumowanie
Jak widzisz, istnieje wiele sposobów na otrzymanie wodorotlenków. Wybór konkretnej metody zależy od właściwości wodorotlenku, który chcemy otrzymać, dostępnych surowców i technologii oraz skali produkcji.
Rozumiejąc te podstawowe metody, możesz lepiej docenić rolę wodorotlenków w otaczającym nas świecie i zrozumieć, jak chemia wpływa na nasze codzienne życie. Mam nadzieję, że ten artykuł przybliżył Ci proces otrzymywania tych ważnych związków chemicznych.
Pamiętaj, chemia to fascynująca dziedzina, która kryje w sobie wiele niespodzianek. Zachęcam do dalszego zgłębiania wiedzy i odkrywania tajemnic świata chemicznego!