Metoda Otrzymywania Wodorotlenków

Wodorotlenki, związki chemiczne o ogólnym wzorze M(OH)n, gdzie M to metal a OH to grupa wodorotlenowa, są niezwykle istotne w chemii i przemyśle. Znajdują zastosowanie w neutralizacji kwasów, produkcji mydeł, oczyszczaniu ścieków, a także w syntezie wielu innych związków. Zrozumienie metod otrzymywania wodorotlenków jest kluczowe dla studentów chemii, chemików-analityków oraz inżynierów procesowych. W niniejszym artykule omówimy najważniejsze i najczęściej stosowane metody, wraz z przykładami i wyjaśnieniami.
Główne Metody Otrzymywania Wodorotlenków
Istnieje kilka fundamentalnych metod otrzymywania wodorotlenków, które różnią się zastosowaniem, wydajnością oraz kosztami. Poniżej przedstawiamy najpopularniejsze z nich.
Reakcja Metali z Wodą
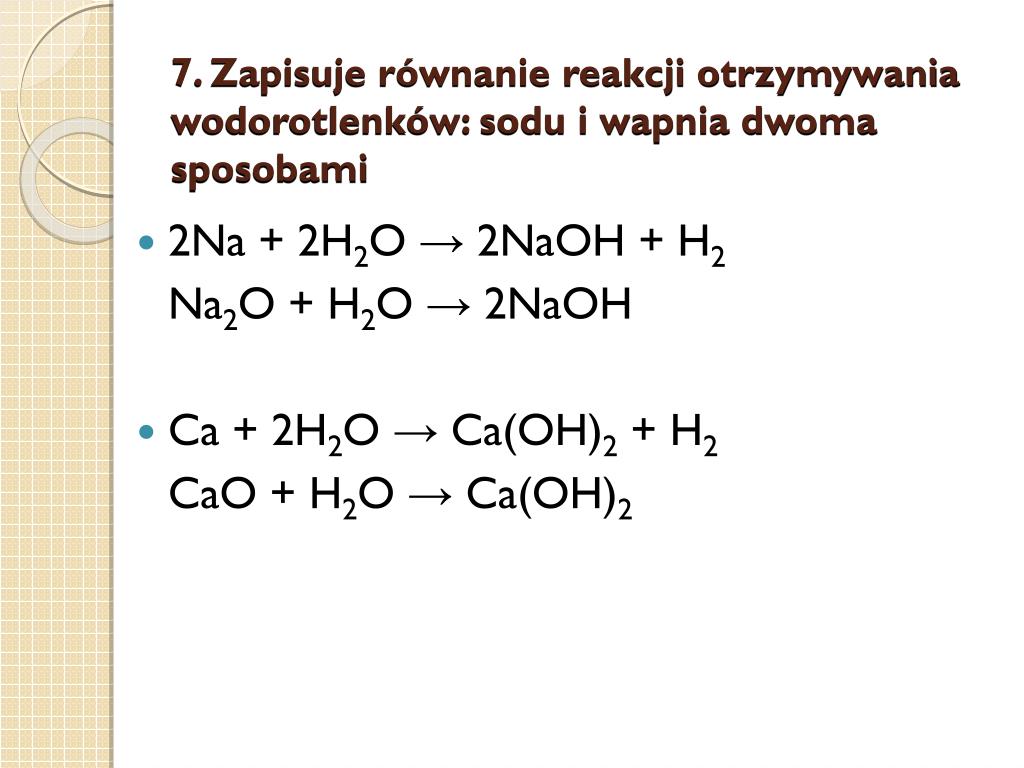
Reakcja metali z wodą jest jedną z najprostszych metod otrzymywania wodorotlenków. Aktywne metale, takie jak lit (Li), sód (Na), potas (K), rubid (Rb) i cez (Cs), reagują z wodą gwałtownie, tworząc wodorotlenek danego metalu i wodór. Reakcja ta jest egzotermiczna, co oznacza, że wydziela się ciepło.
Ogólny zapis reakcji: 2M + 2H2O → 2MOH + H2
Przykład: 2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
W przypadku metali mniej aktywnych, takich jak magnez (Mg) i wapń (Ca), reakcja przebiega wolniej, a często wymaga podgrzania wody. Magnez reaguje z gorącą wodą lub parą wodną, tworząc wodorotlenek magnezu i wodór.
Przykład: Mg(s) + 2H2O(g) → Mg(OH)2(s) + H2(g)
Należy pamiętać, że reakcja z wodą jest bardzo niebezpieczna, zwłaszcza w przypadku metali alkalicznych, ze względu na wydzielanie się wodoru, który jest gazem wybuchowym. Ponadto, reakcja jest silnie egzotermiczna, co może prowadzić do zapłonu wodoru.
Reakcja Tlenków Metali z Wodą
Reakcja tlenków metali z wodą jest kolejną popularną metodą otrzymywania wodorotlenków. Tlenki metali alkalicznych (Li2O, Na2O, K2O) i tlenki metali ziem alkalicznych (MgO, CaO, SrO, BaO) reagują z wodą, tworząc odpowiednie wodorotlenki.
Ogólny zapis reakcji: MxOy + yH2O → xM(OH)2y/x
Przykłady:
- Na2O(s) + H2O(l) → 2NaOH(aq)
- CaO(s) + H2O(l) → Ca(OH)2(aq)
W przypadku tlenków metali o niższej aktywności, reakcja może przebiegać wolniej lub wymagać podwyższonej temperatury. Wodorotlenki metali ziem alkalicznych, takie jak wodorotlenek wapnia (Ca(OH)2), są słabo rozpuszczalne w wodzie.
Reakcja Soli Metali z Zasadami
Reakcja soli metali z zasadami, zwana również reakcją strąceniową, jest wykorzystywana do otrzymywania nierozpuszczalnych wodorotlenków metali. Do roztworu soli metalu dodaje się roztwór zasady (np. NaOH, KOH). Jeżeli wodorotlenek metalu jest nierozpuszczalny, wytrąca się osad.
Ogólny zapis reakcji: Mn+(aq) + nOH-(aq) → M(OH)n(s) (jeżeli M(OH)n jest nierozpuszczalny)
Przykłady:
- FeCl3(aq) + 3NaOH(aq) → Fe(OH)3(s) + 3NaCl(aq) (wodorotlenek żelaza(III) jest osadem)
- CuSO4(aq) + 2NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq) (wodorotlenek miedzi(II) jest osadem)
W reakcji tej ważna jest znajomość rozpuszczalności wodorotlenków metali. Wodorotlenki metali alkalicznych (NaOH, KOH, LiOH) są dobrze rozpuszczalne w wodzie i nie wytrącają się w reakcjach strąceniowych. Do strącania wodorotlenków stosuje się najczęściej wodorotlenki sodu (NaOH) lub potasu (KOH) ze względu na ich dostępność i relatywnie niską cenę.
Elektroliza Roztworów Soli
Elektroliza roztworów soli jest metodą wykorzystywaną do otrzymywania wodorotlenków, zwłaszcza w przemyśle. W procesie elektrolizy roztworu soli, na katodzie wydziela się wodór, a w jej otoczeniu zwiększa się stężenie jonów wodorotlenkowych (OH-), co prowadzi do powstania wodorotlenku. Jednocześnie, na anodzie wydziela się chlor (w przypadku elektrolizy roztworu chlorku sodu) lub tlen (w przypadku elektrolizy roztworów soli zawierających tlenki).
Przykład: Elektroliza roztworu NaCl (metoda chloralkali)
Reakcje zachodzące na elektrodach:
- Katoda (-): 2H2O(l) + 2e- → H2(g) + 2OH-(aq)
- Anoda (+): 2Cl-(aq) → Cl2(g) + 2e-
Równanie sumaryczne: 2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + H2(g) + Cl2(g)
Metoda elektrolizy roztworów soli jest szeroko stosowana w przemyśle chemicznym do produkcji wodorotlenku sodu (NaOH), chloru (Cl2) i wodoru (H2). Proces ten wymaga dużych nakładów energii, dlatego optymalizacja procesów elektrolitycznych jest kluczowa dla obniżenia kosztów produkcji.
Real-World Examples and Data
Przemysł chemiczny wykorzystuje wodorotlenki na ogromną skalę. Produkcja NaOH (sody kaustycznej) na świecie wynosi kilkadziesiąt milionów ton rocznie. Jest on wykorzystywany w przemyśle papierniczym, tekstylnym, mydlarskim, a także w procesach rafinacji ropy naftowej. Wodorotlenek wapnia (Ca(OH)2), znany jako wapno gaszone, jest stosowany w budownictwie, rolnictwie (do odkwaszania gleby) i oczyszczaniu ścieków. Wodorotlenek magnezu (Mg(OH)2) jest stosowany jako środek neutralizujący kwasy żołądkowe.
Dane dotyczące produkcji: Według raportów branżowych, globalna produkcja wodorotlenku sodu (NaOH) w 2022 roku wyniosła około 78 milionów ton. Największymi producentami są Chiny, Stany Zjednoczone i Europa. Zapotrzebowanie na NaOH stale rośnie ze względu na rozwój przemysłu chemicznego i rosnące zastosowania w oczyszczaniu ścieków.
Oczyszczanie ścieków: Wodorotlenki, zwłaszcza wodorotlenek wapnia (wapno), są powszechnie stosowane w procesach oczyszczania ścieków. Służą do neutralizacji kwaśnych ścieków, wytrącania metali ciężkich i usuwania fosforanów. Dodatek wodorotlenku wapnia powoduje zwiększenie pH ścieków, co sprzyja wytrącaniu się metali ciężkich w postaci nierozpuszczalnych wodorotlenków. Ponadto, wapno reaguje z fosforanami, tworząc nierozpuszczalny fosforan wapnia, który może być łatwo usunięty ze ścieków.
Conclusion
Otrzymywanie wodorotlenków jest zagadnieniem fundamentalnym w chemii i przemyśle. Znajomość metod otrzymywania, ich zalet i wad jest niezbędna dla chemików, inżynierów i technologów. Od prostych reakcji metali z wodą, po zaawansowane procesy elektrolityczne, każda metoda ma swoje specyficzne zastosowanie. Wybór odpowiedniej metody zależy od wielu czynników, takich jak skala produkcji, dostępność surowców, koszty energii i wymagania dotyczące czystości produktu. Zachęcamy do dalszego zgłębiania wiedzy na temat wodorotlenków i ich zastosowań, gdyż są to związki niezwykle wszechstronne i niezastąpione w wielu dziedzinach nauki i technologii.