Metal Kwas Sól Wodór Przykłady
Reakcje metali z kwasami są fundamentalnym aspektem chemii, ilustrującym interakcje między elektronami, jonami i strukturą atomową. Proces ten prowadzi do powstawania soli i uwalniania wodoru. Zrozumienie tych reakcji jest kluczowe w wielu dziedzinach, od przemysłu po biologię.
Podstawy reakcji metali z kwasami
Reakcja metalu z kwasem zasadniczo polega na utlenianiu metalu przez jony wodorowe (H+) obecne w kwasie. Metal, oddając elektrony, przechodzi w formę jonową (kation), natomiast jony wodorowe przyjmują te elektrony, tworząc gazowy wodór (H2).
Mechanizm reakcji
Proces można rozłożyć na następujące etapy:
- Dysocjacja kwasu: Kwas rozpuszcza się w wodzie, uwalniając jony wodorowe (H+) i aniony kwasowe (np. Cl- w przypadku kwasu solnego).
- Utlenianie metalu: Metal oddaje elektrony. Liczba oddawanych elektronów zależy od wartościowości metalu. Na przykład, sód (Na) oddaje jeden elektron, a magnez (Mg) oddaje dwa.
- Redukcja jonów wodorowych: Jony wodorowe przyjmują elektrony oddane przez metal, tworząc atomowy wodór (H). Atomy wodoru następnie łączą się, tworząc cząsteczkowy wodór (H2).
- Powstawanie soli: Kation metalu łączy się z anionem kwasowym, tworząc sól.
Ogólny zapis reakcji można przedstawić następująco:
Metal + Kwas → Sól + Wodór
Czynniki wpływające na szybkość reakcji
Szybkość reakcji metali z kwasami zależy od wielu czynników:
Aktywność metalu
Aktywność metalu jest kluczowym czynnikiem. Metale bardziej aktywne, czyli te, które łatwiej oddają elektrony, reagują z kwasami szybciej. Aktywność metali można określić za pomocą szeregu elektrochemicznego (szeregu napięciowego). Metale znajdujące się wyżej w tym szeregu (np. potas, sód, lit) są bardziej aktywne niż te znajdujące się niżej (np. miedź, srebro, złoto). Metale poniżej wodoru w szeregu elektrochemicznym zazwyczaj nie reagują z kwasami (z wyjątkiem kwasów utleniających).
Przykład: Sód (Na) reaguje z kwasem solnym (HCl) bardzo gwałtownie, z wydzieleniem dużej ilości ciepła i wodoru. Miedź (Cu), znajdująca się niżej w szeregu aktywności, nie reaguje z rozcieńczonym kwasem solnym.
Stężenie kwasu
Stężenie kwasu ma bezpośredni wpływ na szybkość reakcji. Wyższe stężenie kwasu oznacza większą liczbę jonów wodorowych (H+) dostępnych do reakcji, co zwiększa jej szybkość.
Przykład: Reakcja cynku (Zn) z rozcieńczonym kwasem siarkowym (H2SO4) przebiega wolniej niż reakcja z stężonym kwasem siarkowym (przy zachowaniu ostrożności, ze względu na potencjalne zagrożenia związane z użyciem stężonych kwasów).
Temperatura
Temperatura, jak w większości reakcji chemicznych, wpływa na szybkość reakcji metali z kwasami. Wyższa temperatura zwiększa energię kinetyczną cząsteczek, co prowadzi do częstszych i bardziej efektywnych zderzeń między metalem a jonami wodorowymi.
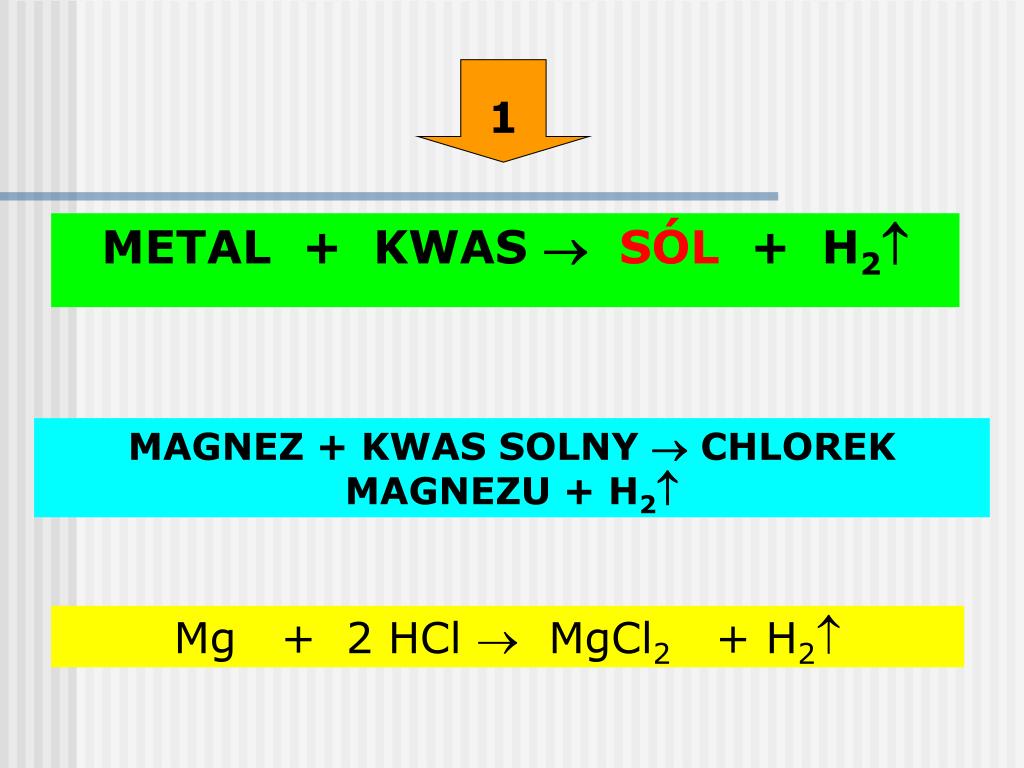
Przykład: Reakcja magnezu (Mg) z kwasem solnym (HCl) przebiega szybciej w wyższej temperaturze.
Powierzchnia kontaktu
Powierzchnia kontaktu metalu z kwasem również ma znaczenie. Metal w postaci proszku (duża powierzchnia) reaguje szybciej niż ten sam metal w postaci bloku (mała powierzchnia).
Przykład: Opilki żelaza (Fe) reagują z kwasem solnym (HCl) szybciej niż kawałek żelaza o tej samej masie.
Obecność katalizatorów
Katalizatory mogą przyspieszać niektóre reakcje, choć nie są one powszechnie stosowane w reakcjach metali z kwasami w sposób bezpośredni. Jednakże, obecność innych substancji w roztworze może wpływać na przebieg reakcji.
Przykłady reakcji metali z kwasami
Poniżej przedstawiono kilka przykładów reakcji metali z kwasami:
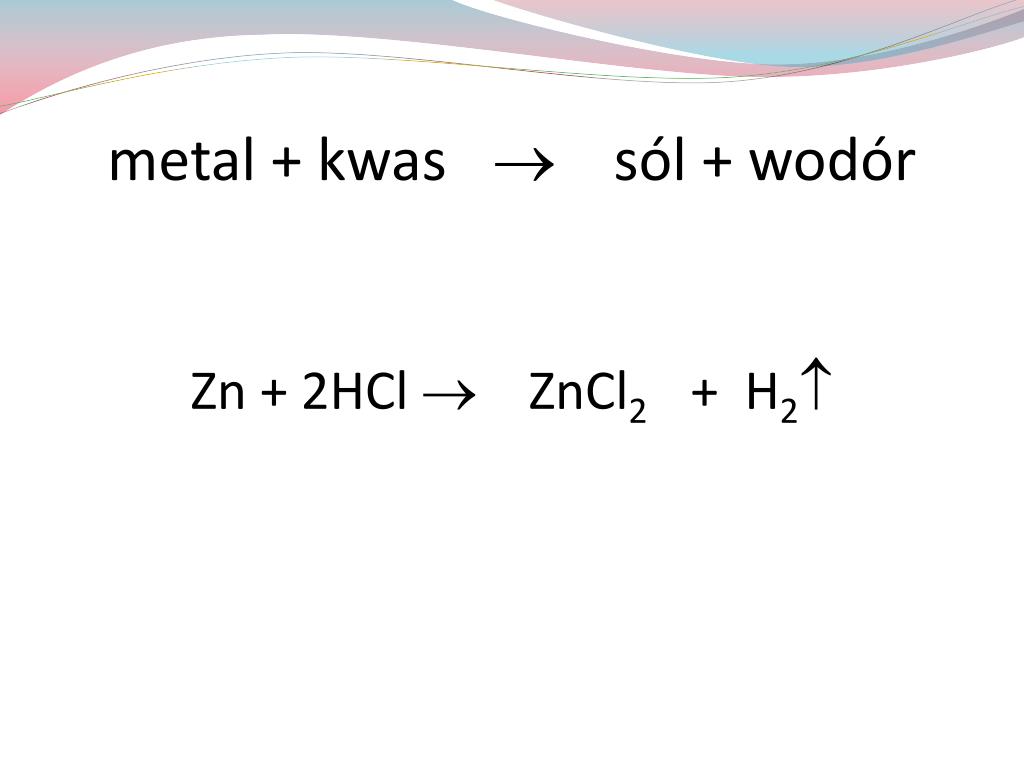
- Reakcja cynku z kwasem solnym: Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
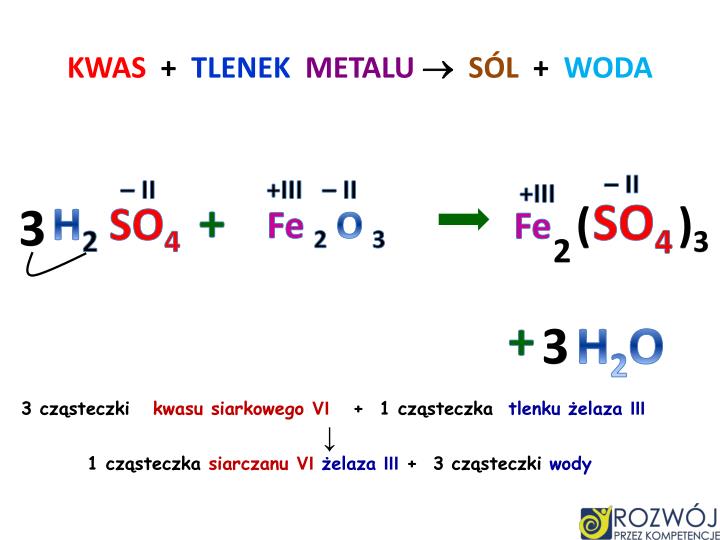
- Reakcja magnezu z kwasem siarkowym: Mg(s) + H2SO4(aq) → MgSO4(aq) + H2(g)
- Reakcja żelaza z kwasem solnym: Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
- Reakcja glinu z kwasem solnym: 2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g)
Cynk reaguje z kwasem solnym, tworząc chlorek cynku (sól) i gazowy wodór.
Magnez reaguje z kwasem siarkowym, tworząc siarczan magnezu (sól) i gazowy wodór.
Żelazo reaguje z kwasem solnym, tworząc chlorek żelaza(II) (sól) i gazowy wodór.
Glin reaguje z kwasem solnym, tworząc chlorek glinu (sól) i gazowy wodór.
Wpływ na środowisko i przemysł
Reakcje metali z kwasami mają znaczący wpływ na środowisko i przemysł:
- Korrozja: Korozja metali jest procesem, w którym metale reagują z substancjami obecnymi w środowisku, takimi jak kwasy zawarte w deszczu, co prowadzi do ich degradacji. Ten proces ma ogromne konsekwencje ekonomiczne i środowiskowe.
- Produkcja wodoru: Reakcje metali z kwasami są wykorzystywane do produkcji wodoru, który jest obiecującym nośnikiem energii.
- Procesy metalurgiczne: Reakcje kwasów z metalami są stosowane w procesach rafinacji i oczyszczania metali.
- Oczyszczanie ścieków: Niektóre metale, takie jak żelazo, są wykorzystywane do oczyszczania ścieków, neutralizując kwasy.
Bezpieczeństwo
Praca z kwasami i metalami wymaga zachowania szczególnej ostrożności:
- Stosowanie odzieży ochronnej: Należy zawsze nosić okulary ochronne, rękawice i fartuch, aby chronić skórę i oczy przed kontaktem z kwasami.
- Praca w dobrze wentylowanym pomieszczeniu: Reakcje metali z kwasami często prowadzą do wydzielania gazowego wodoru, który jest łatwopalny. Należy zapewnić dobrą wentylację, aby uniknąć gromadzenia się wodoru w powietrzu.
- Unikanie mieszania nieznanych substancji: Należy unikać mieszania kwasów z nieznanymi substancjami, ponieważ reakcje mogą być gwałtowne i niebezpieczne.
- Prawidłowe przechowywanie: Kwasy powinny być przechowywane w odpowiednich pojemnikach, z dala od substancji, z którymi mogą reagować.
Podsumowanie
Reakcje metali z kwasami są fundamentalne dla zrozumienia chemii i mają szerokie zastosowanie w przemysle i życiu codziennym. Zrozumienie mechanizmów tych reakcji, czynników wpływających na ich szybkość, oraz środków bezpieczeństwa jest kluczowe dla efektywnego i bezpiecznego korzystania z nich. Kontynuuj eksplorację fascynującego świata chemii, aby w pełni docenić potęgę i piękno tych interakcji!