Masa Atomowa Siarki Wynosi 16 U
W chemii, zrozumienie podstawowych właściwości atomów jest kluczowe dla zrozumienia reakcji i budowy związków. Jedną z fundamentalnych właściwości jest masa atomowa. W tym artykule skupimy się na masie atomowej siarki, która wynosi 16 u (jednostek masy atomowej) lub 16 Da (daltonów). Zbadamy co to oznacza, jak się ją określa i jakie ma implikacje w różnych dziedzinach nauki.
Czym jest Masa Atomowa?
Masa atomowa to masa atomu, wyrażona w jednostkach masy atomowej (u lub Da). Jednostka masy atomowej jest zdefiniowana jako 1/12 masy atomu węgla-12. Masa atomowa atomu danego pierwiastka jest średnią ważoną mas wszystkich jego naturalnie występujących izotopów, uwzględniającą ich względną obfitość. Oznacza to, że uwzględnia fakt, iż dany pierwiastek może występować w kilku wersjach o różnej liczbie neutronów w jądrze, a zatem o nieco różnej masie.
Izotopy i ich Wpływ na Masę Atomową
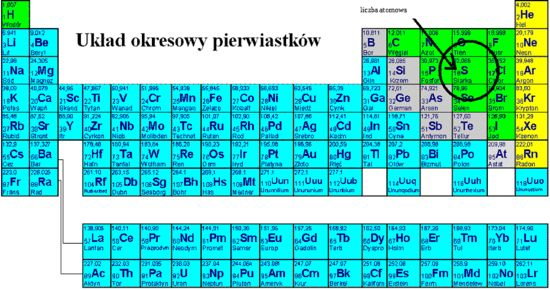
Izotopy to atomy tego samego pierwiastka, które mają różną liczbę neutronów. Na przykład, siarka ma kilka izotopów, z których najważniejsze to: siarka-32 (32S), siarka-33 (33S), siarka-34 (34S) i siarka-36 (36S). Każdy z tych izotopów ma inną masę, ponieważ ma inną liczbę neutronów. Obfitość każdego z tych izotopów w przyrodzie jest różna. Przy obliczaniu średniej masy atomowej siarki, musimy uwzględnić te obfitości. Na przykład, siarka-32 jest najczęściej występującym izotopem siarki (około 95%).
Siarka i Jej Izotopy
Siarka (S) to pierwiastek chemiczny należący do grupy tlenowców w układzie okresowym. Jej liczba atomowa wynosi 16, co oznacza, że każdy atom siarki posiada 16 protonów w jądrze. Różnica w liczbie neutronów determinuje, jaki izotop siarki mamy. Masa atomowa 16 u, o której mówimy, jest pewnym uproszczeniem, ponieważ uwzględnia średnią ważoną mas poszczególnych izotopów. Bardziej precyzyjna wartość masy atomowej siarki, którą można znaleźć w układzie okresowym, jest zbliżona do 32.06 u.
Obliczenie Średniej Masy Atomowej Siarki
Aby obliczyć średnią masę atomową siarki, potrzebujemy informacji o masie każdego izotopu i jego obfitości w naturze. Załóżmy, że mamy następujące dane (dane są przybliżone dla celów ilustracyjnych):
- 32S: Masa = 31.972 u, Obfitość = 95.02%
- 33S: Masa = 32.971 u, Obfitość = 0.75%
- 34S: Masa = 33.967 u, Obfitość = 4.21%
- 36S: Masa = 35.967 u, Obfitość = 0.02%
Średnią masę atomową obliczamy w następujący sposób:
Średnia masa atomowa = (Masa 32S * Obfitość 32S) + (Masa 33S * Obfitość 33S) + (Masa 34S * Obfitość 34S) + (Masa 36S * Obfitość 36S)
Średnia masa atomowa = (31.972 * 0.9502) + (32.971 * 0.0075) + (33.967 * 0.0421) + (35.967 * 0.0002) ≈ 32.06 u
Jak widzimy, wynik jest zbliżony do wartości podawanej w układzie okresowym. Ważne jest, aby pamiętać, że są to wartości przybliżone, a dokładne pomiary masy atomowej wymagają użycia spektrometrii mas.
Zastosowania i Znaczenie Znajomości Masy Atomowej Siarki
Znajomość masy atomowej siarki, choć na pierwszy rzut oka wydaje się abstrakcyjna, ma ogromne znaczenie w wielu dziedzinach nauki i przemysłu.
Chemia
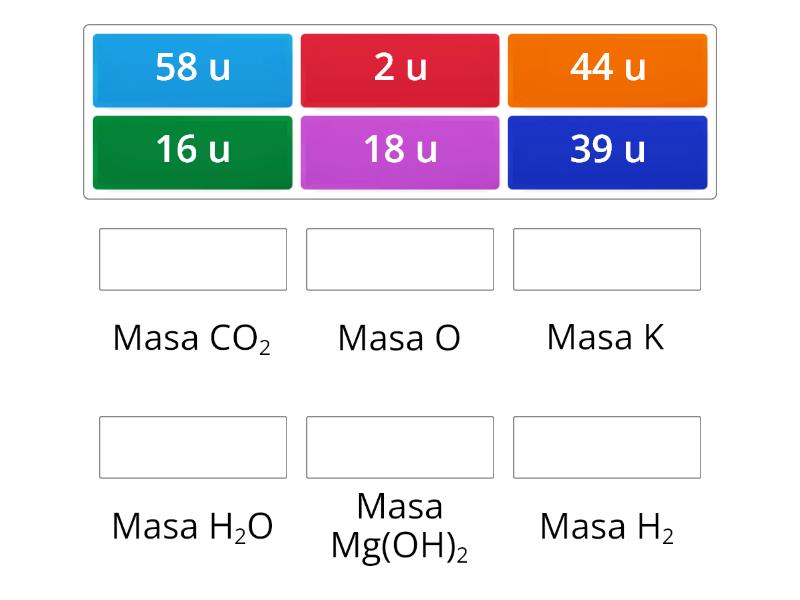
W chemii, masa atomowa jest fundamentalna do obliczania mas molowych związków chemicznych zawierających siarkę. Dzięki masie molowej możemy precyzyjnie odmierzać ilości reagentów w reakcjach chemicznych, co jest kluczowe dla syntezy chemicznej i analizy chemicznej. Na przykład, aby zsyntetyzować kwas siarkowy (H2SO4), musimy znać masę molową siarki, tlenu i wodoru.
Biologia
W biologii, siarka jest składnikiem aminokwasów, takich jak cysteina i metionina, które są podstawowymi jednostkami budulcowymi białek. Znajomość masy atomowej siarki jest niezbędna do określania struktury i właściwości białek, a także do obliczeń związanych z metabolizmem siarki w organizmach żywych. Białka zawierające wiązania dwusiarczkowe (S-S) odgrywają kluczową rolę w stabilizacji struktury przestrzennej wielu enzymów i innych białek funkcjonalnych.
Geologia
W geologii, izotopy siarki są używane do datowania skał i minerałów, a także do śledzenia pochodzenia siarki w złożach rud i ropy naftowej. Analiza izotopowa siarki może dostarczyć cennych informacji na temat procesów geologicznych zachodzących w przeszłości. Różnice w obfitości izotopów siarki w różnych środowiskach geologicznych pozwalają na odróżnienie różnych źródeł siarki i rekonstrukcję historii geologiczną danego obszaru.
Przemysł
W przemyśle, siarka jest używana do produkcji kwasu siarkowego (H2SO4), który jest jednym z najważniejszych chemikaliów przemysłowych. Kwas siarkowy jest wykorzystywany w produkcji nawozów, detergentów, tworzyw sztucznych i wielu innych produktów. Znajomość masy atomowej siarki jest niezbędna do optymalizacji procesów produkcyjnych i kontroli jakości produktów.
Przykłady i Dane Rzeczywiste
Przykład 1: Produkcja kwasu siarkowego. Zakład chemiczny potrzebuje wyprodukować 1000 kg kwasu siarkowego (H2SO4). Aby to zrobić, muszą dokładnie odmierzyć ilość siarki potrzebną do reakcji. Znając masę molową siarki (ok. 32 g/mol) oraz masę molową kwasu siarkowego (ok. 98 g/mol), można obliczyć, ile gramów siarki potrzeba, aby otrzymać 1000 kg kwasu siarkowego.
Przykład 2: Analiza składu aminokwasowego białka. Laboratorium biologiczne analizuje białko i chce określić zawartość cysteiny, aminokwasu zawierającego siarkę. Znając masę atomową siarki, można dokładnie określić zawartość cysteiny w badanym białku.
Dane Rzeczywiste: Badania izotopowe siarki w osadach morskich pozwoliły na zrekonstruowanie zmian w warunkach redox oceanu w przeszłości. Zmiany w stosunku izotopów siarki (34S/32S) w osadach wskazują na zmiany w aktywności bakterii redukujących siarczany i cyklu biogeochemicznym siarki. Te badania pomagają zrozumieć wpływ zmian klimatycznych na ekosystemy morskie.
Podsumowanie i Wnioski
Masa atomowa siarki, choć często upraszczana do wartości 16 u, jest w rzeczywistości średnią ważoną mas wszystkich izotopów siarki, uwzględniającą ich naturalną obfitość. Dokładna wartość masy atomowej siarki jest kluczowa w wielu dziedzinach nauki i przemysłu, od chemii i biologii po geologię i inżynierię materiałową. Znajomość masy atomowej siarki pozwala na precyzyjne obliczenia stechiometryczne, analizę składu związków chemicznych, datowanie skał i minerałów, a także na optymalizację procesów produkcyjnych.
Aby w pełni docenić znaczenie masy atomowej, zachęcam do dalszego zgłębiania wiedzy na temat izotopów i ich zastosowań w różnych dziedzinach nauki. Rozważ zapoznanie się z technikami spektrometrii mas, które pozwalają na precyzyjne pomiary masy atomowej i obfitości izotopów. Świadomość tych fundamentalnych zasad chemii pozwoli Ci lepiej zrozumieć świat wokół nas i przyczynić się do rozwoju nauki i technologii.