Masa Atomowa A Masa Cząsteczkowa

Rozumienie podstawowych pojęć chemicznych jest kluczowe dla zgłębiania tajników materii. Dwa z najważniejszych to masa atomowa i masa cząsteczkowa. Często mylone, choć ściśle powiązane, opisują fundamentalne właściwości atomów i cząsteczek. W tym artykule przyjrzymy się bliżej tym dwóm pojęciom, wyjaśniając ich definicje, różnice, sposób obliczania oraz ich znaczenie w chemii i życiu codziennym.
Masa Atomowa: Fundamentalna Charakterystyka Pierwiastka
Definicja i Jednostki
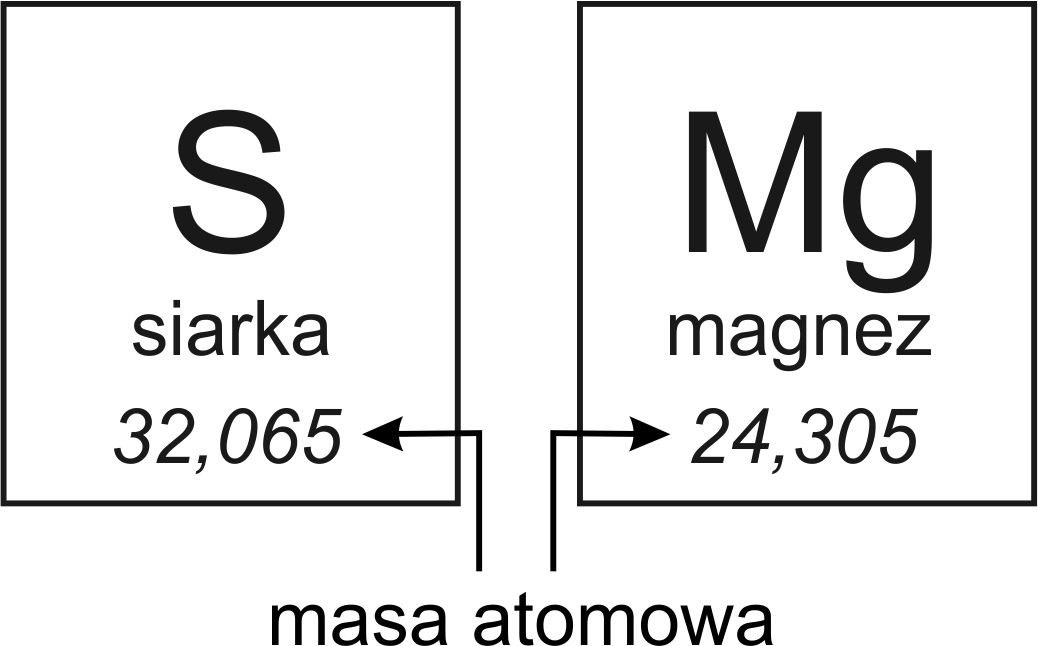
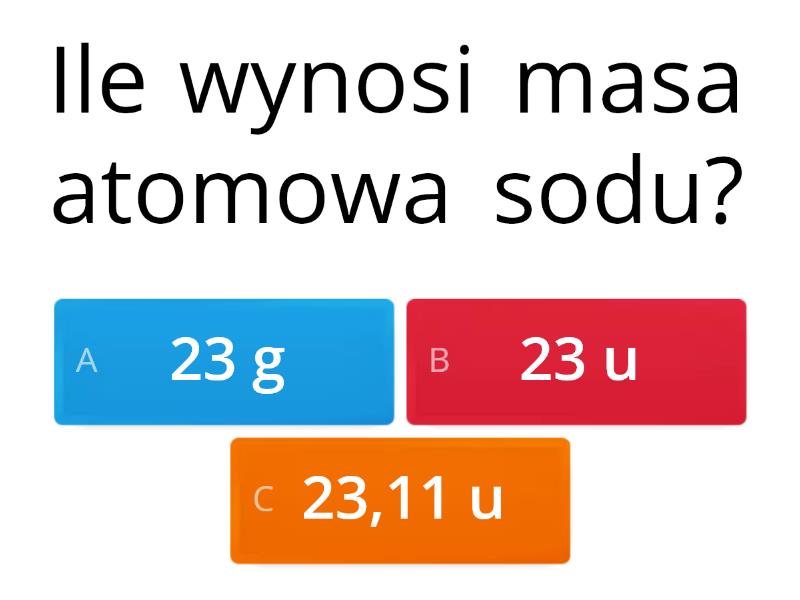
Masa atomowa to masa pojedynczego atomu danego pierwiastka. Jest to jednak wartość *względna*, ponieważ nie wyrażamy jej w gramach lub kilogramach, lecz w unitach masy atomowej (u), czasami nazywanych daltonami (Da). Jeden unit masy atomowej jest zdefiniowany jako 1/12 masy atomu węgla-12 (12C). Dlaczego akurat węgiel-12? Ponieważ jest to izotop węgla o stabilnym jądrze i jego masa jest dobrze znana.
Zatem, masa atomowa pierwiastka odpowiada średniej masie atomów pierwiastka, uwzględniając izotopy i ich naturalną obfitość. Izotopy to atomy tego samego pierwiastka, które mają różną liczbę neutronów w jądrze, a zatem różną masę.
Obliczanie Średniej Masy Atomowej
Aby obliczyć średnią masę atomową pierwiastka, należy wziąć pod uwagę masy wszystkich jego izotopów oraz ich procentową zawartość w naturze. Wzór jest następujący:
Średnia masa atomowa = (masa izotopu 1 * procentowa zawartość izotopu 1) + (masa izotopu 2 * procentowa zawartość izotopu 2) + ... + (masa izotopu n * procentowa zawartość izotopu n)
Przykład: Chlor (Cl) występuje w dwóch głównych izotopach: chlor-35 (35Cl) o masie 34,969 u i zawartości 75,77% oraz chlor-37 (37Cl) o masie 36,966 u i zawartości 24,23%. Zatem średnia masa atomowa chloru wynosi:
(34,969 u * 0,7577) + (36,966 u * 0,2423) = 26,495 u + 8,957 u = 35,452 u
Zatem, masa atomowa chloru, którą znajdziemy w układzie okresowym, wynosi około 35,45 u.
Rola w Układzie Okresowym
Masy atomowe pierwiastków są umieszczone w układzie okresowym. Zazwyczaj znajdują się pod symbolem danego pierwiastka. Są one kluczowe do określania ilości substancji w reakcjach chemicznych i do obliczania mas molowych związków.
Masa Cząsteczkowa: Mierzenie Wielkości Związków
Definicja i Jednostki
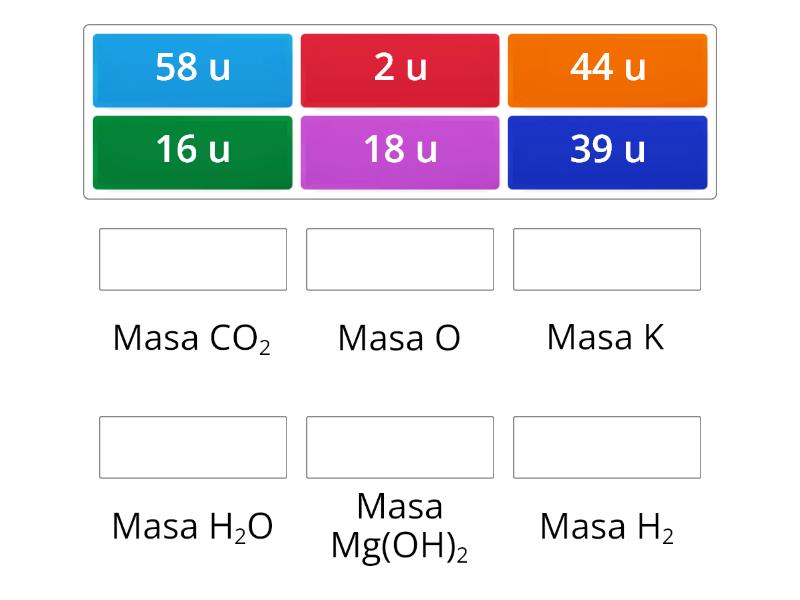
Masa cząsteczkowa to masa pojedynczej cząsteczki danego związku chemicznego. Oblicza się ją, sumując masy atomowe wszystkich atomów, które wchodzą w skład cząsteczki. Podobnie jak masa atomowa, masa cząsteczkowa jest wyrażana w unitach masy atomowej (u) lub daltonach (Da).
Obliczanie Masy Cząsteczkowej
Aby obliczyć masę cząsteczkową związku, należy znać jego wzór chemiczny i masy atomowe poszczególnych pierwiastków, które go tworzą. Następnie mnożymy masę atomową każdego pierwiastka przez liczbę jego atomów w cząsteczce i sumujemy wyniki.
Przykład 1: Woda (H2O)
Masa atomowa wodoru (H) = 1,008 u
Masa atomowa tlenu (O) = 16,00 u
Masa cząsteczkowa H2O = (2 * 1,008 u) + (1 * 16,00 u) = 2,016 u + 16,00 u = 18,016 u
Zatem, masa cząsteczkowa wody wynosi około 18,02 u.
Przykład 2: Glukoza (C6H12O6)
Masa atomowa węgla (C) = 12,01 u
Masa atomowa wodoru (H) = 1,008 u
Masa atomowa tlenu (O) = 16,00 u
Masa cząsteczkowa C6H12O6 = (6 * 12,01 u) + (12 * 1,008 u) + (6 * 16,00 u) = 72,06 u + 12,096 u + 96,00 u = 180,156 u
Zatem, masa cząsteczkowa glukozy wynosi około 180,16 u.
Różnica między Masą Cząsteczkową a Masą Molową
Ważne jest, aby odróżnić masę cząsteczkową od masy molowej. Masa cząsteczkowa odnosi się do pojedynczej cząsteczki i jest wyrażana w unitach masy atomowej (u), natomiast masa molowa odnosi się do jednego mola substancji (6,022 x 1023 cząsteczek) i jest wyrażana w gramach na mol (g/mol). Numerycznie, wartość masy cząsteczkowej w unitach masy atomowej jest równa wartości masy molowej w gramach na mol.
Przykład: Dla wody (H2O), masa cząsteczkowa wynosi około 18,02 u, a masa molowa wynosi około 18,02 g/mol.
Zastosowania w Chemii i Życiu Codziennym
Zarówno masa atomowa, jak i masa cząsteczkowa odgrywają kluczową rolę w wielu aspektach chemii i życia codziennego:
- Obliczenia stechiometryczne: Pozwalają na obliczanie ilości reagentów i produktów w reakcjach chemicznych. Dzięki znajomości mas atomowych i cząsteczkowych możemy określić, ile gramów substancji potrzebujemy, aby przeprowadzić daną reakcję.
- Analiza chemiczna: Używane w analizie składu związków chemicznych, np. w chromatografii gazowej sprzężonej z spektrometrią mas (GC-MS).
- Farmacja: Kluczowe przy projektowaniu i syntezie leków. Znajomość masy cząsteczkowej leku pozwala na określenie dawki, jaką należy podać pacjentowi.
- Przemysł spożywczy: Wykorzystywane w analizie składu żywności, np. do określania zawartości składników odżywczych.
- Badania naukowe: Niezbędne w wielu dziedzinach nauki, takich jak chemia, fizyka, biologia i materiałoznawstwo.
Real-World Data: Rola w Diagnostyce Medycznej
Spektrometria mas jest zaawansowaną techniką analityczną wykorzystywaną w diagnostyce medycznej. Masa cząsteczkowa biomarkerów (np. białek, lipidów, metabolitów) jest oznaczana z wysoką precyzją, umożliwiając identyfikację specyficznych profili molekularnych związanych z daną chorobą. Na przykład, wczesne wykrywanie raka jajnika opiera się na analizie profilu białek w próbkach krwi, gdzie zmiana w stężeniu białek o określonej masie cząsteczkowej może sygnalizować obecność nowotworu. Podobnie, spektrometria mas znajduje zastosowanie w identyfikacji bakterii i wirusów na podstawie ich charakterystycznych profili białkowych, co jest kluczowe w szybkiej i skutecznej diagnozie infekcji.
Podsumowanie i Wnioski
Podsumowując, masa atomowa to średnia masa atomu danego pierwiastka, uwzględniająca jego izotopy, wyrażana w unitach masy atomowej (u). Masa cząsteczkowa to suma mas atomowych wszystkich atomów wchodzących w skład cząsteczki, również wyrażana w unitach masy atomowej (u). Oba pojęcia są fundamentalne dla chemii i pokrewnych dziedzin, umożliwiając precyzyjne obliczenia i analizy składu materii. Zrozumienie ich różnic i sposobu obliczania jest niezbędne dla każdego, kto zajmuje się chemią, biologią, farmacją lub innymi naukami przyrodniczymi.
Zachęcamy do dalszego zgłębiania wiedzy z zakresu chemii! Zrozumienie podstawowych pojęć to klucz do odkrywania fascynującego świata molekuł i reakcji, które zachodzą wokół nas.