łączenie Się Atomów Równania Reakcji Chemicznych Sprawdzian Klasa 7 Pdf

Drodzy uczniowie klasy 7,
Wasze pytania dotyczące łączenia się atomów, równań reakcji chemicznych i sprawdzianów (w formacie PDF) rozumiem i postaram się na nie odpowiedzieć w sposób wyczerpujący. Przygotujcie się na solidną dawkę wiedzy!
Zacznijmy od fundamentów: atomy. Te maleńkie cegiełki, z których zbudowana jest cała materia, posiadają pewną "chęć" łączenia się ze sobą. Ta "chęć" wynika z dążenia do osiągnięcia stanu jak najniższej energii, stanu stabilności. Stabilność tę atomy osiągają najczęściej poprzez uzyskanie konfiguracji elektronowej najbliższej gazom szlachetnym, czyli posiadanie pełnej powłoki walencyjnej (8 elektronów, z wyjątkiem helu, który ma 2).
Jak to się dzieje w praktyce? Otóż, atomy mogą łączyć się na kilka sposobów, tworząc różne rodzaje wiązań chemicznych. Najważniejsze z nich to:
-
Wiązanie jonowe: Powstaje między atomami o dużej różnicy elektroujemności (czyli zdolności przyciągania elektronów). Atom o wyższej elektroujemności "kradnie" elektron(y) atomowi o niższej elektroujemności. W ten sposób powstają jony: kation (jon dodatni, który oddał elektron(y)) i anion (jon ujemny, który przyjął elektron(y)). Między jonami o przeciwnych znakach występuje silne przyciąganie elektrostatyczne, które utrzymuje je razem, tworząc wiązanie jonowe. Typowym przykładem jest chlorek sodu (NaCl), czyli sól kuchenna. Sód (Na) oddaje elektron chlorowi (Cl), tworząc jon Na+ i jon Cl-.
-
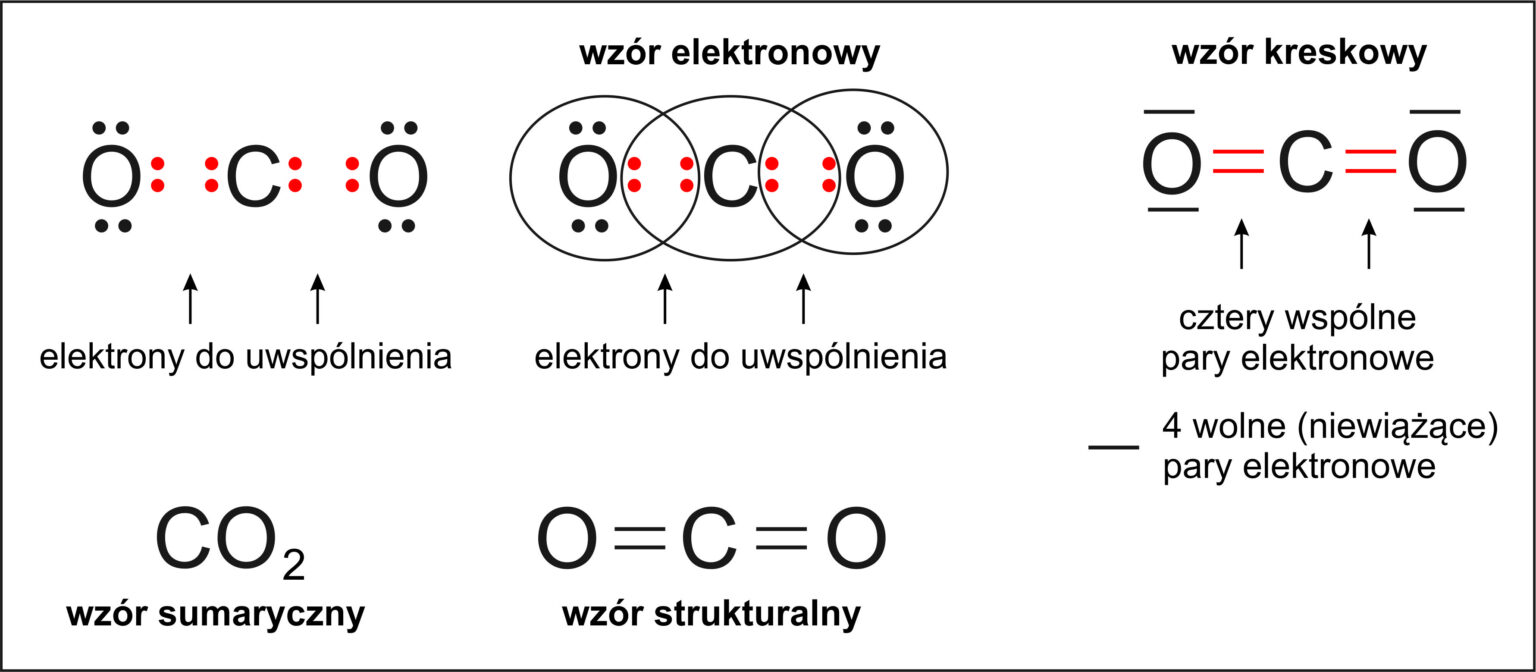
Wiązanie kowalencyjne: Powstaje między atomami o zbliżonej elektroujemności. Zamiast "kraść" elektrony, atomy "dzielą się" nimi. Pary elektronowe, które są wspólnie użytkowane przez dwa atomy, tworzą wiązanie kowalencyjne. W zależności od liczby wspólnych par elektronowych, wiązanie kowalencyjne może być pojedyncze (jedna para elektronowa), podwójne (dwie pary elektronowe) lub potrójne (trzy pary elektronowe). Przykładem jest cząsteczka wody (H2O). Atom tlenu (O) dzieli się elektronami z dwoma atomami wodoru (H).
- Wiązanie kowalencyjne spolaryzowane: To szczególny przypadek wiązania kowalencyjnego, w którym wspólna para elektronowa jest przesunięta w stronę atomu o wyższej elektroujemności. Powoduje to powstanie cząstkowego ładunku ujemnego na atomie o wyższej elektroujemności i cząstkowego ładunku dodatniego na atomie o niższej elektroujemności. Cząsteczki z wiązaniami kowalencyjnymi spolaryzowanymi nazywamy dipolami. Przykładem jest ponownie cząsteczka wody. Tlen jest bardziej elektroujemny niż wodór, więc para elektronowa jest przesunięta w jego stronę, co powoduje, że tlen ma cząstkowy ładunek ujemny, a wodór cząstkowy ładunek dodatni.
-
Wiązanie metaliczne: Występuje w metalach. Atomy metali oddają elektrony walencyjne, tworząc sieć kationów metali "zanurzonych" w "morzu" elektronów. Te swobodne elektrony poruszają się po całej strukturze metalu, co odpowiada za jego właściwości, takie jak przewodnictwo elektryczne i cieplne.
Gdy atomy łączą się ze sobą, tworzą cząsteczki lub sieci krystaliczne. Cząsteczki to trwałe zgrupowania atomów połączonych wiązaniami chemicznymi. Natomiast sieci krystaliczne to uporządkowane struktury przestrzenne, w których atomy, jony lub cząsteczki są ułożone w powtarzający się wzór.
Równania Reakcji Chemicznych: Klucz do Zrozumienia Przemian
Teraz przejdźmy do równań reakcji chemicznych. Równanie reakcji chemicznej to zapis symboliczny, który przedstawia przebieg reakcji chemicznej. Składa się z substratów (czyli substancji wyjściowych), produktów (czyli substancji powstałych w wyniku reakcji) oraz strzałki wskazującej kierunek reakcji.
Na przykład:
2 H₂ + O₂ → 2 H₂O
Oznacza to, że dwie cząsteczki wodoru (H₂) reagują z jedną cząsteczką tlenu (O₂), tworząc dwie cząsteczki wody (H₂O). Liczby przed symbolami chemicznymi (tzw. współczynniki stechiometryczne) informują o stosunku molowym substratów i produktów w reakcji. Ważne jest, aby równanie reakcji było zbilansowane, czyli żeby liczba atomów każdego pierwiastka była taka sama po obu stronach równania. Balansowanie równania reakcji polega na dobraniu odpowiednich współczynników stechiometrycznych.
Jak balansować równania reakcji? Istnieje kilka metod, ale najczęściej stosuje się metodę prób i błędów. Polega ona na stopniowym dobieraniu współczynników, aż do uzyskania zgodności liczby atomów każdego pierwiastka po obu stronach równania.
Weźmy prosty przykład:
H₂ + Cl₂ → HCl
Po lewej stronie mamy 2 atomy wodoru i 2 atomy chloru, a po prawej stronie tylko 1 atom wodoru i 1 atom chloru. Aby zbilansować to równanie, musimy dodać współczynnik 2 przed HCl:
H₂ + Cl₂ → 2 HCl
Teraz po obu stronach równania mamy po 2 atomy wodoru i 2 atomy chloru, więc równanie jest zbilansowane.
Równania reakcji chemicznych są niezwykle ważne, ponieważ pozwalają nam przewidywać, ile produktu powstanie z określonej ilości substratów. Możemy obliczać masy substratów potrzebnych do uzyskania danej masy produktu, a także obliczać wydajność reakcji.
Rodzaje Reakcji Chemicznych
Ważne jest, aby rozróżniać różne rodzaje reakcji chemicznych. Do najczęściej spotykanych należą:
-
Reakcja syntezy: Dwa lub więcej substratów łączą się, tworząc jeden produkt. Na przykład: N₂ + 3 H₂ → 2 NH₃ (synteza amoniaku)
-
Reakcja analizy (rozkładu): Jeden substrat rozkłada się na dwa lub więcej produktów. Na przykład: 2 H₂O → 2 H₂ + O₂ (elektroliza wody)
-
Reakcja wymiany: Atomy lub grupy atomów w związkach chemicznych wymieniają się miejscami. Wyróżniamy:
- Reakcja pojedynczej wymiany: Jeden pierwiastek wypiera inny pierwiastek z związku chemicznego. Na przykład: Zn + CuSO₄ → ZnSO₄ + Cu (cynk wypiera miedź z siarczanu miedzi)
- Reakcja podwójnej wymiany: Dwa związki chemiczne wymieniają się swoimi jonami. Na przykład: AgNO₃ + NaCl → AgCl↓ + NaNO₃ (azotan srebra reaguje z chlorkiem sodu, tworząc osad chlorku srebra)
Sprawdzian Klasa 7 PDF: Przygotowanie
Na koniec, kilka słów o sprawdzianie. Najważniejsze jest, aby dobrze zrozumieć materiał. Przeróbcie zadania z podręcznika, rozwiążcie dodatkowe ćwiczenia. Zwróćcie szczególną uwagę na:
- Rozróżnianie różnych rodzajów wiązań chemicznych i ich właściwości.
- Zapisywanie i balansowanie równań reakcji chemicznych.
- Rozpoznawanie różnych rodzajów reakcji chemicznych.
- Obliczanie mas molowych i korzystanie z prawa zachowania masy.
- Nazewnictwo prostych związków chemicznych (tlenki, wodorotlenki, kwasy, sole).
Jeśli macie dostęp do przykładowych sprawdzianów w formacie PDF, przeanalizujcie je. Zwróćcie uwagę na typy zadań, które się pojawiają. Starajcie się rozwiązywać je samodzielnie, a następnie sprawdźcie odpowiedzi. W razie wątpliwości, pytajcie! To naturalne, że coś może być niezrozumiałe. Lepiej wyjaśnić to teraz, niż stracić punkty na sprawdzianie.
Pamiętajcie, że kluczem do sukcesu jest systematyczna nauka i solidne zrozumienie materiału. Powodzenia na sprawdzianie! Mam nadzieję, że ta obszerna odpowiedź na wasze pytania okaże się pomocna. Jeżeli pojawią się kolejne pytania, nie wahajcie się ich zadać. Chętnie pomogę!