łączenie Się Atomów Równania Reakcji Chemicznych Sprawdzian Klasa 7

Drodzy uczniowie klasy 7! Zbliża się sprawdzian, wiem. Zatem poświęćmy chwilę na dogłębne omówienie zagadnień związanych z łączeniem się atomów i równaniami reakcji chemicznych. Przygotujcie się na solidną dawkę wiedzy!
Zacznijmy od absolutnych podstaw. Atomy, jak wiecie, dążą do stabilności. Stabilność ta osiągana jest poprzez uzyskanie konfiguracji elektronowej gazu szlachetnego, czyli posiadanie 8 elektronów na ostatniej powłoce walencyjnej (oktet elektronowy), z wyjątkiem helu, który dąży do 2 elektronów (dublet elektronowy). Ten cel determinuje sposób, w jaki atomy łączą się ze sobą.
Łączenie się Atomów
Wyróżniamy kilka głównych rodzajów wiązań chemicznych, które decydują o połączeniach między atomami: wiązania jonowe, kowalencyjne (atomowe) oraz metaliczne. Każdy z nich charakteryzuje się innym mechanizmem powstawania i wpływa na właściwości powstałych związków.
Wiązanie Jonowe:
Wiązanie jonowe powstaje w wyniku przekazania elektronu od atomu o niskiej elektroujemności (metalu) do atomu o wysokiej elektroujemności (niemetalu). Atom, który oddaje elektron, staje się kationem (jonem dodatnim), natomiast atom, który przyjmuje elektron, staje się anionem (jonem ujemnym). Powstałe jony przyciągają się elektrostatycznie, tworząc wiązanie jonowe. Klasycznym przykładem jest chlorek sodu (NaCl), gdzie atom sodu (Na) oddaje elektron atomowi chloru (Cl), tworząc jony Na+ i Cl-. Zauważmy, że związki jonowe tworzą zazwyczaj sieci krystaliczne, a nie pojedyncze cząsteczki.
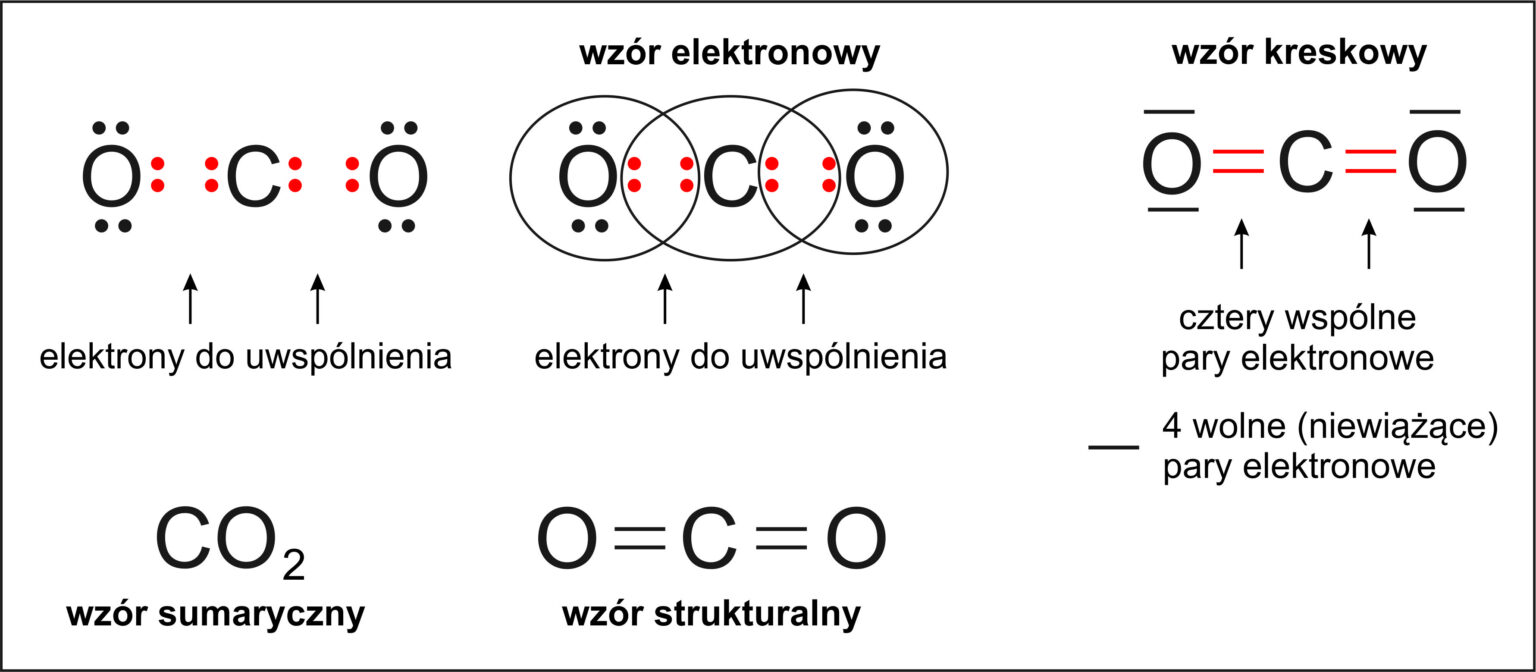
Wiązanie Kowalencyjne (Atomowe):
Wiązanie kowalencyjne powstaje poprzez uwspólnianie elektronów między atomami. W ten sposób każdy z atomów dąży do uzyskania oktetu elektronowego na powłoce walencyjnej. Wiązanie kowalencyjne występuje najczęściej między niemetalami.
Wyróżniamy wiązania kowalencyjne niespolaryzowane i spolaryzowane. Wiązanie kowalencyjne niespolaryzowane powstaje, gdy elektrony są równomiernie rozłożone między atomami, co ma miejsce, gdy atomy mają taką samą lub bardzo zbliżoną elektroujemność (np. w cząsteczce wodoru, H2). Wiązanie kowalencyjne spolaryzowane powstaje, gdy elektrony są przesunięte w stronę atomu o wyższej elektroujemności (np. w cząsteczce wody, H2O). Atom o wyższej elektroujemności uzyskuje wówczas cząstkowy ładunek ujemny (δ-), a atom o niższej elektroujemności – cząstkowy ładunek dodatni (δ+).
Wiązanie Metaliczne:
Wiązanie metaliczne występuje w metalach. Atomy metali oddają swoje elektrony walencyjne, tworząc "morze elektronowe", w którym zanurzone są kationy metali. Elektrony te są swobodnie przemieszczane w całej strukturze, co odpowiada za dobre przewodnictwo elektryczne i cieplne metali.
Równania Reakcji Chemicznych
Równania reakcji chemicznych to zapis symboliczny przebiegu reakcji chemicznej. Muszą one spełniać zasadę zachowania masy, co oznacza, że liczba atomów każdego pierwiastka po stronie substratów (reagujących) musi być równa liczbie atomów tego pierwiastka po stronie produktów (powstałych).
Zapis Równania Reakcji Chemicznej:
Substraty piszemy po lewej stronie równania, a produkty po prawej stronie. Substancje oddzielamy znakiem "+" (plus). Strzałka (→) wskazuje kierunek reakcji. W przypadku reakcji odwracalnych stosuje się podwójną strzałkę (⇄). Stan skupienia substancji oznaczamy w nawiasach za symbolem lub wzorem chemicznym: (s) – ciało stałe, (l) – ciecz, (g) – gaz, (aq) – roztwór wodny.
Uzgadnianie Równań Reakcji Chemicznych:
Uzgadnianie równań reakcji chemicznych polega na dobraniu odpowiednich współczynników stechiometrycznych przed symbolami lub wzorami chemicznymi substancji tak, aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania.
-
Określenie substratów i produktów reakcji: Należy dokładnie zidentyfikować, jakie substancje reagują ze sobą i jakie substancje powstają w wyniku reakcji.
-
Zapisanie szkieletu równania reakcji: Należy zapisać symbole lub wzory chemiczne substratów i produktów, oddzielając je strzałką.
-
Ustalenie współczynników stechiometrycznych: Należy dobrać współczynniki tak, aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania. Zaczynamy zazwyczaj od pierwiastków, które występują w najmniejszej liczbie związków. Metodą prób i błędów, lub używając metod bardziej zaawansowanych, takich jak metoda bilansu elektronowego (dla reakcji redoks), doprowadzamy równanie do stanu zbilansowanego.
Przykłady Równań Reakcji Chemicznych:
-
Synteza wody: 2 H2(g) + O2(g) → 2 H2O(g) W tym przypadku, dwa atomy wodoru łączą się z jednym atomem tlenu, tworząc dwie cząsteczki wody.
-
Rozkład tlenku rtęci(II): 2 HgO(s) → 2 Hg(l) + O2(g) Pod wpływem ciepła, tlenek rtęci(II) rozkłada się na rtęć i tlen.
-
Reakcja kwasu solnego z cynkiem: Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g) Cynk reaguje z kwasem solnym, tworząc chlorek cynku i wodór.
Rodzaje Reakcji Chemicznych:
W chemii wyróżniamy wiele rodzajów reakcji chemicznych, ale do najważniejszych należą:
-
Reakcje syntezy (łączenia): Dwie lub więcej substancji reaguje ze sobą, tworząc jedną, bardziej złożoną substancję (np. N2 + 3 H2 → 2 NH3).
-
Reakcje analizy (rozkładu): Jedna substancja rozkłada się na dwie lub więcej prostszych substancji (np. 2 H2O → 2 H2 + O2).
-
Reakcje wymiany: Atom lub grupa atomów w jednej substancji jest zastępowana przez atom lub grupę atomów w innej substancji. Wyróżniamy reakcje pojedynczej wymiany (A + BC → AC + B) oraz reakcje podwójnej wymiany (AB + CD → AD + CB).
-
Reakcje spalania: Substancja reaguje z tlenem, wydzielając ciepło i światło. Spalanie może być całkowite (produktami są dwutlenek węgla i woda) lub niecałkowite (produktami są tlenek węgla, węgiel i woda). Na przykład: CH4 + 2 O2 → CO2 + 2 H2O.
Stechiometria:
Stechiometria to dział chemii zajmujący się ilościowymi zależnościami między substratami i produktami reakcji chemicznych. Na podstawie równania reakcji chemicznej można obliczyć, ile substancji potrzeba do przeprowadzenia reakcji, oraz ile substancji powstanie w wyniku reakcji. Do tego celu wykorzystuje się współczynniki stechiometryczne, które informują o stosunku molowym substratów i produktów.
Przykładowe obliczenia stechiometryczne:
Załóżmy, że mamy równanie reakcji: 2 H2 + O2 → 2 H2O.
Z równania wynika, że 2 mole wodoru reagują z 1 molem tlenu, tworząc 2 mole wody. Możemy zatem obliczyć, ile gramów wody powstanie, jeśli przereaguje 4 gramy wodoru.
Masa molowa wodoru (H2) wynosi 2 g/mol, więc 4 g wodoru to 2 mole wodoru. Z równania wynika, że 2 mole wodoru tworzą 2 mole wody. Masa molowa wody (H2O) wynosi 18 g/mol, więc 2 mole wody to 36 gramów wody. Zatem z 4 gramów wodoru powstanie 36 gramów wody.
Reakcje Redoks (Utleniania-Redukcji):
Reakcje redoks to reakcje, w których następuje zmiana stopni utlenienia atomów. Utlenianie to proces oddawania elektronów przez atom, jon lub cząsteczkę, co powoduje wzrost stopnia utlenienia. Redukcja to proces przyjmowania elektronów przez atom, jon lub cząsteczkę, co powoduje obniżenie stopnia utlenienia.
W każdej reakcji redoks występuje utleniacz (substancja, która przyjmuje elektrony i ulega redukcji) oraz reduktor (substancja, która oddaje elektrony i ulega utlenieniu).
Ustalanie Stopni Utlenienia:
Aby ustalić stopnie utlenienia atomów w związkach chemicznych, należy przestrzegać następujących zasad:
-
Stopień utlenienia pierwiastka w stanie wolnym wynosi 0.
-
Stopień utlenienia tlenu w związkach wynosi zazwyczaj -2 (wyjątkiem są nadtlenki, gdzie wynosi -1, oraz fluorek tlenu, OF2, gdzie wynosi +2).
-
Stopień utlenienia wodoru w związkach wynosi zazwyczaj +1 (wyjątkiem są wodorki metali, gdzie wynosi -1).
-
Suma stopni utlenienia wszystkich atomów w cząsteczce obojętnej musi wynosić 0.
-
Suma stopni utlenienia wszystkich atomów w jonie musi być równa ładunkowi jonu.
Przykłady Reakcji Redoks:
-
Reakcja cynku z kwasem solnym: Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g) W tej reakcji cynk (Zn) utlenia się (oddaje elektrony) i przechodzi ze stopnia utlenienia 0 do +2, natomiast wodór (H) redukuje się (przyjmuje elektrony) i przechodzi ze stopnia utlenienia +1 do 0.
-
Reakcja spalania węgla: C(s) + O2(g) → CO2(g) Węgiel (C) utlenia się (oddaje elektrony) i przechodzi ze stopnia utlenienia 0 do +4, natomiast tlen (O) redukuje się (przyjmuje elektrony) i przechodzi ze stopnia utlenienia 0 do -2.
Pamiętajcie, aby dokładnie analizować równania reakcji chemicznych, identyfikować substraty i produkty, ustalać współczynniki stechiometryczne i określać rodzaje reakcji. Wiedza ta jest kluczowa do zrozumienia procesów chemicznych i rozwiązywania zadań. Powodzenia na sprawdzianie!