Kwasy Wzory Sumaryczne I Strukturalne
Chemia potrafi być fascynująca, ale czasami napotyka się na terminy, które na pierwszy rzut oka wydają się skomplikowane. Jednym z takich tematów są kwasy. Nie martw się! Postaramy się je zrozumieć w przystępny sposób, koncentrując się na ich wzorach sumarycznych i strukturalnych. Użyjemy wielu przykładów i porównań, aby wszystko stało się jasne, szczególnie dla tych, którzy najlepiej uczą się przez obrazy.
Czym właściwie są kwasy?
Wyobraź sobie, że kwasy to jak... uparci maniacy oddawania elektronów, a konkretnie jonów wodorowych (H+). Trochę jak ktoś, kto ciągle oferuje ci swoje ciasteczka – kwasy ciągle chcą oddać swoje "H+". W chemii, definicja kwasu to substancja, która dysocjuje (rozpada się) w wodzie, tworząc jony wodorowe (H+). Im więcej tych jonów w roztworze, tym bardziej kwasowy jest ten roztwór.
Pomyśl o soku z cytryny. Ma kwaśny smak, prawda? To dlatego, że zawiera kwas cytrynowy. Ocet, którego używasz w kuchni, zawdzięcza swój charakterystyczny zapach i smak kwasowi octowemu. Nawet Twój żołądek produkuje kwas solny (HCl), który pomaga trawić jedzenie! Widzisz, kwasy są wszędzie wokół nas.
Wzory Sumaryczne – Krótki kod kwasu
Wzór sumaryczny to jak skrótowa notatka o tym, co dany kwas zawiera. Mówi nam, ile atomów każdego pierwiastka znajduje się w cząsteczce kwasu. Jest to bardzo przydatne, gdy chcemy szybko zobaczyć skład chemiczny, bez zagłębiania się w szczegóły budowy.
Na przykład:
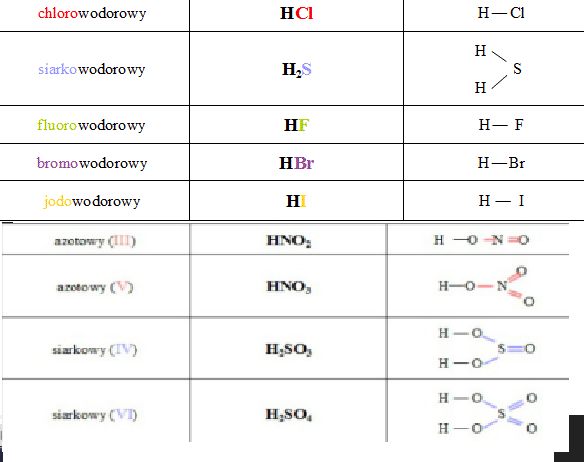
- HCl (Kwas solny): Jeden atom wodoru (H) i jeden atom chloru (Cl). Proste, prawda?
- H2SO4 (Kwas siarkowy): Dwa atomy wodoru (H), jeden atom siarki (S) i cztery atomy tlenu (O). Już trochę bardziej skomplikowane, ale nadal czytelne.
- HNO3 (Kwas azotowy): Jeden atom wodoru (H), jeden atom azotu (N) i trzy atomy tlenu (O).
Zauważ, że wzory sumaryczne mówią tylko o liczbie atomów każdego pierwiastka, a nie o tym, jak są one połączone. To tak, jakby powiedzieć, że przepis na ciasto zawiera mąkę, jajka i cukier, ale nie tłumaczyć, jak je wymieszać.
Wzory Strukturalne – Plan architektoniczny kwasu
Wzór strukturalny to jak "zdjęcie" cząsteczki kwasu. Pokazuje, jak atomy są ze sobą połączone i jak wyglądają wiązania między nimi. Jest to znacznie bardziej szczegółowy sposób reprezentacji kwasu niż wzór sumaryczny.
Wyobraź sobie, że wzór sumaryczny to jak lista zakupów do budowy domu (cegły, drewno, cement), a wzór strukturalny to jak plan architektoniczny, który pokazuje, gdzie każda cegła ma być umieszczona.
Spójrzmy na kilka przykładów:
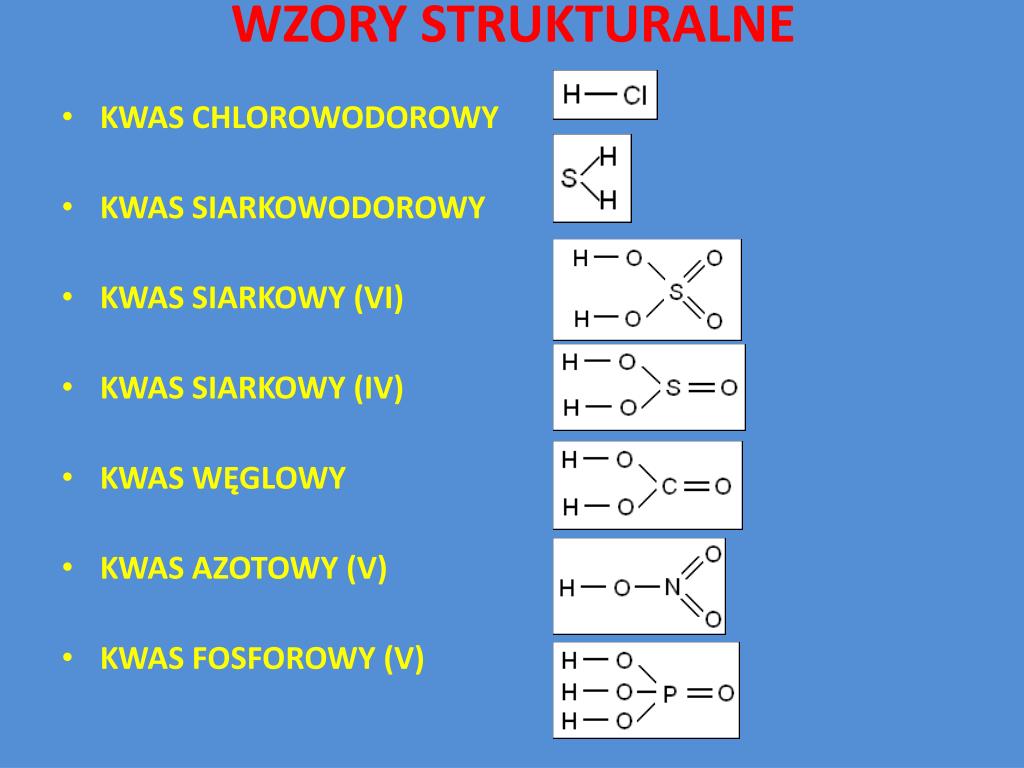
Kwas Solny (HCl)
Wzór sumaryczny: HCl
Wzór strukturalny: H-Cl
Tutaj widzimy, że atom wodoru jest połączony pojedynczym wiązaniem z atomem chloru. Bardzo proste!
Kwas Siarkowy (H2SO4)
Wzór sumaryczny: H2SO4
Wzór strukturalny:
O=S(=O)(O)(O)
| |
H H
(lub, w bardziej tradycyjnym zapisie rysunkowym, atom siarki w centrum, z dwoma atomami tlenu połączonymi wiązaniem podwójnym i dwoma połączonymi wiązaniem pojedynczym, każdy z tych ostatnich połączony z atomem wodoru)
Tutaj widzimy, że atom siarki jest połączony z czterema atomami tlenu. Dwa atomy tlenu są połączone z siarką wiązaniem podwójnym, a dwa z nich są połączone pojedynczo, a te z kolei z atomami wodoru. Dzięki wzorowi strukturalnemu możemy zobaczyć, jak dokładnie atomy są ułożone w przestrzeni.
Kwas Octowy (CH3COOH)
Wzór sumaryczny: CH3COOH (lub C2H4O2)
Wzór strukturalny:
O
||
H3C - C - OH
Ten kwas jest nieco bardziej złożony. Widzimy grupę metylową (CH3) połączoną z grupą karboksylową (COOH). W grupie karboksylowej atom węgla jest połączony podwójnym wiązaniem z atomem tlenu i pojedynczym wiązaniem z grupą hydroksylową (OH). To właśnie obecność tej grupy karboksylowej nadaje kwasowi octowemu jego charakterystyczne właściwości.
Dlaczego wzory strukturalne są takie ważne?
Wzory strukturalne są niezwykle ważne, ponieważ pozwalają nam zrozumieć właściwości kwasu. Na przykład, wiedząc, jak atomy są połączone w kwasie siarkowym, możemy przewidzieć, jak będzie reagował z innymi substancjami. Wzór strukturalny pomaga nam zrozumieć reaktywność, polarność i wiele innych cech kwasu.
Wróćmy do przykładu z ciastem. Znając jedynie listę składników (wzór sumaryczny), nie wiemy, jak je połączyć, żeby wyszło smaczne ciasto. Dopiero patrząc na przepis (wzór strukturalny), dowiadujemy się, co z czym wymieszać i w jakiej kolejności, żeby uzyskać pożądany efekt.
Podsumowanie
Pamiętaj:
- Kwasy to substancje, które oddają jony wodorowe (H+) w roztworze wodnym.
- Wzór sumaryczny to skrócona informacja o liczbie atomów każdego pierwiastka w cząsteczce kwasu.
- Wzór strukturalny pokazuje, jak atomy są połączone w cząsteczce kwasu, ujawniając jego budowę przestrzenną i właściwości.
Zrozumienie wzorów sumarycznych i strukturalnych kwasów to klucz do zrozumienia ich właściwości i reakcji chemicznych. Nie bój się chemii! Dzięki wizualizacjom i przykładom z życia codziennego, możesz stać się mistrzem kwasów!
Teraz, gdy masz już solidne podstawy, możesz zacząć eksplorować świat kwasów i ich niesamowitych właściwości. Powodzenia!