Kwasy Tlenowe I Beztlenowe Klasa 8

Czy kiedykolwiek zastanawiałeś się, co sprawia, że ocet jest kwaśny, a woda sodowa ma charakterystyczny smak? Sekret tkwi w kwasach! W klasie ósmej zagłębiamy się w świat kwasów tlenowych i beztlenowych, substancji, które odgrywają kluczową rolę w wielu procesach chemicznych, zarówno w laboratorium, jak i w naszym codziennym życiu. Zrozumienie ich właściwości i różnic jest niezwykle ważne, a wbrew pozorom, nie jest tak trudne, jak mogłoby się wydawać!
Co to są kwasy?
Zacznijmy od podstaw. Kwasy to związki chemiczne, które w roztworze wodnym uwalniają jony wodorowe (H+). To właśnie obecność tych jonów odpowiada za charakterystyczne właściwości kwasów, takie jak kwaśny smak (pamiętaj! Nie wolno smakować substancji w laboratorium!) i zdolność do reagowania z metalami i zasadami.
Kwas można zdefiniować na kilka sposobów, ale dla naszych potrzeb, wystarczy nam definicja mówiąca, że kwas to substancja, która oddaje proton (jon wodorowy).
Aby rozróżnić kwasy, dzielimy je na dwie główne grupy: kwasy tlenowe i beztlenowe.
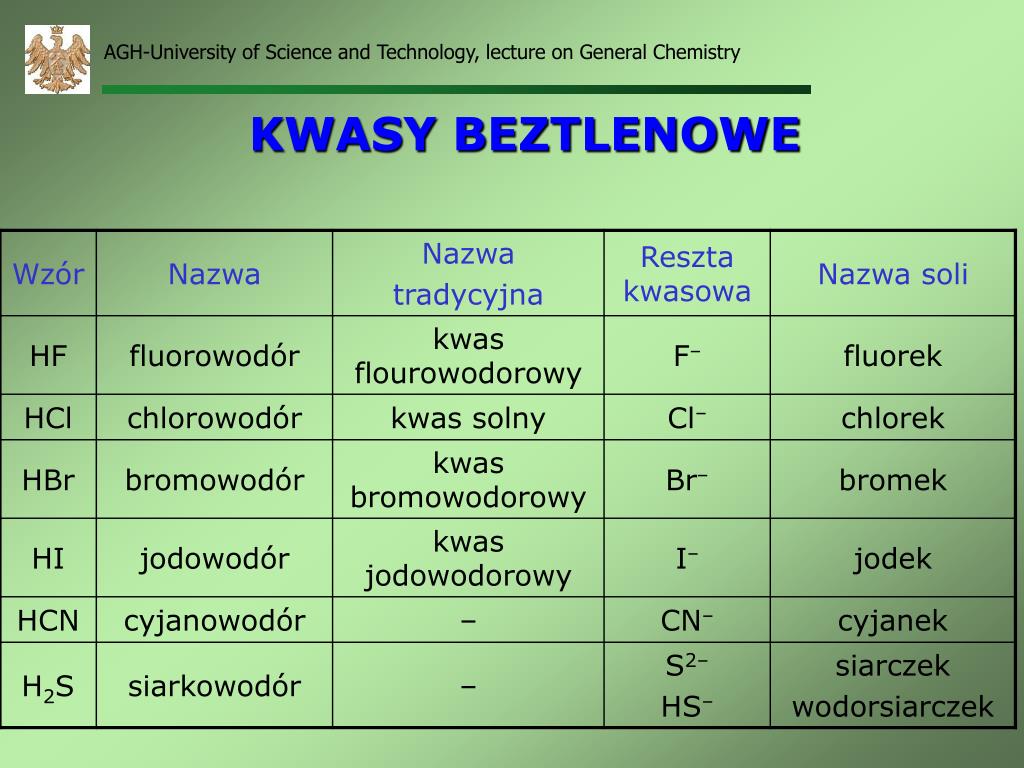
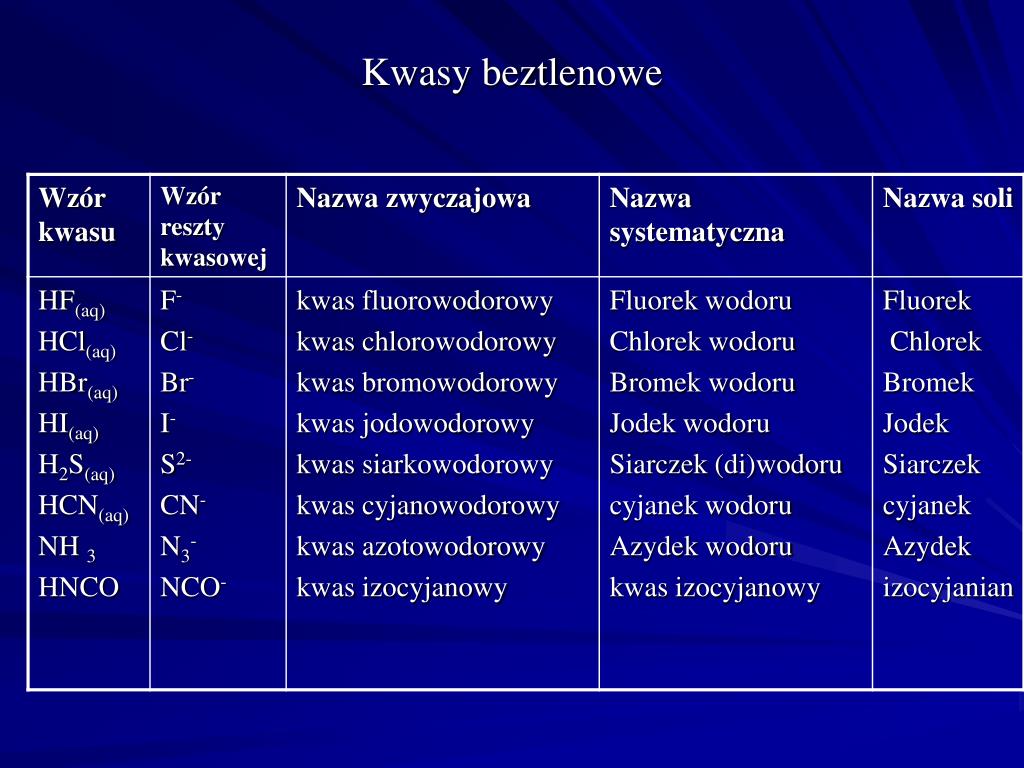
Kwasy beztlenowe – proste i skuteczne
Kwasy beztlenowe to kwasy, które w swojej budowie zawierają atom wodoru i atom niemetalu, ale nie zawierają atomów tlenu. Najczęściej spotykanymi kwasami beztlenowymi są chlorowodorowy (HCl), bromowodorowy (HBr), jodowodorowy (HI) oraz siarkowodorowy (H2S).
Jak powstają kwasy beztlenowe? Najczęściej powstają poprzez rozpuszczenie odpowiedniego gazu w wodzie. Na przykład, chlorowodór (HCl) jest gazem, który rozpuszczony w wodzie tworzy kwas chlorowodorowy, znany również jako kwas solny. Kwas solny jest silnym kwasem, powszechnie stosowanym w przemyśle i laboratoriach.
Przykłady kwasów beztlenowych i ich zastosowania:
- Kwas chlorowodorowy (HCl): Jest obecny w żołądku, gdzie pomaga w trawieniu pokarmów. Stosowany w przemyśle chemicznym do produkcji barwników, tworzyw sztucznych i innych substancji.
- Kwas siarkowodorowy (H2S): Ma charakterystyczny zapach zgniłych jaj. Jest toksyczny i powstaje podczas rozkładu materii organicznej. W laboratoriach używany do analizy jakościowej.
- Kwas bromowodorowy (HBr) i kwas jodowodorowy (HI): Używane w syntezie organicznej, czyli do tworzenia bardziej złożonych związków chemicznych.
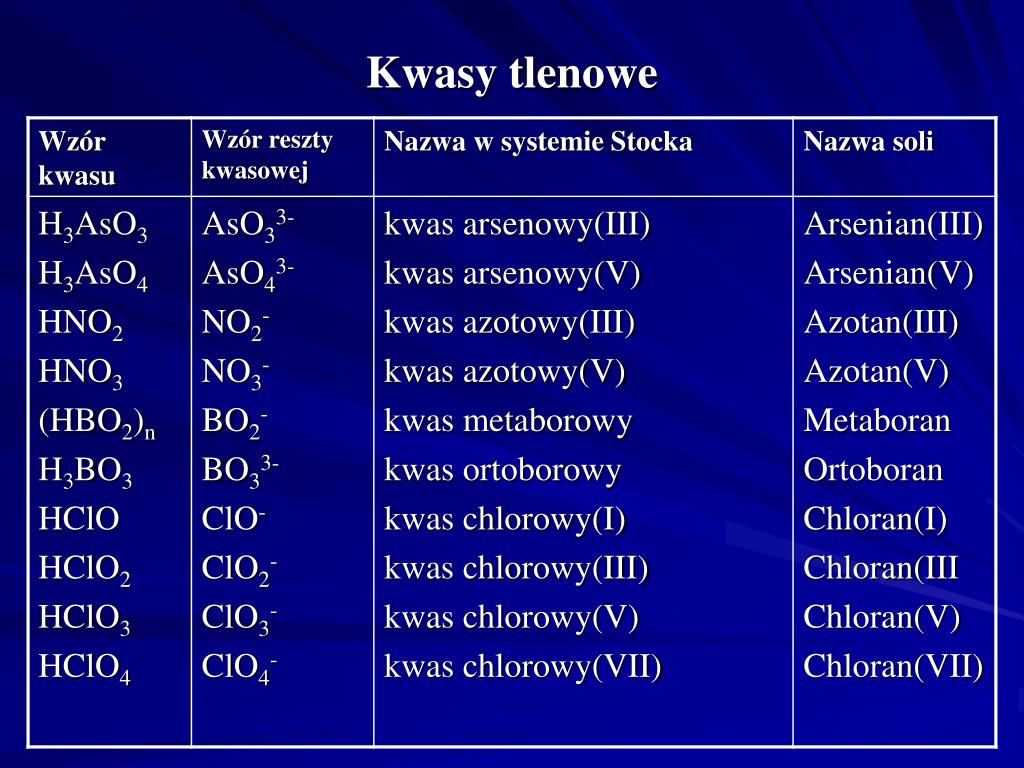
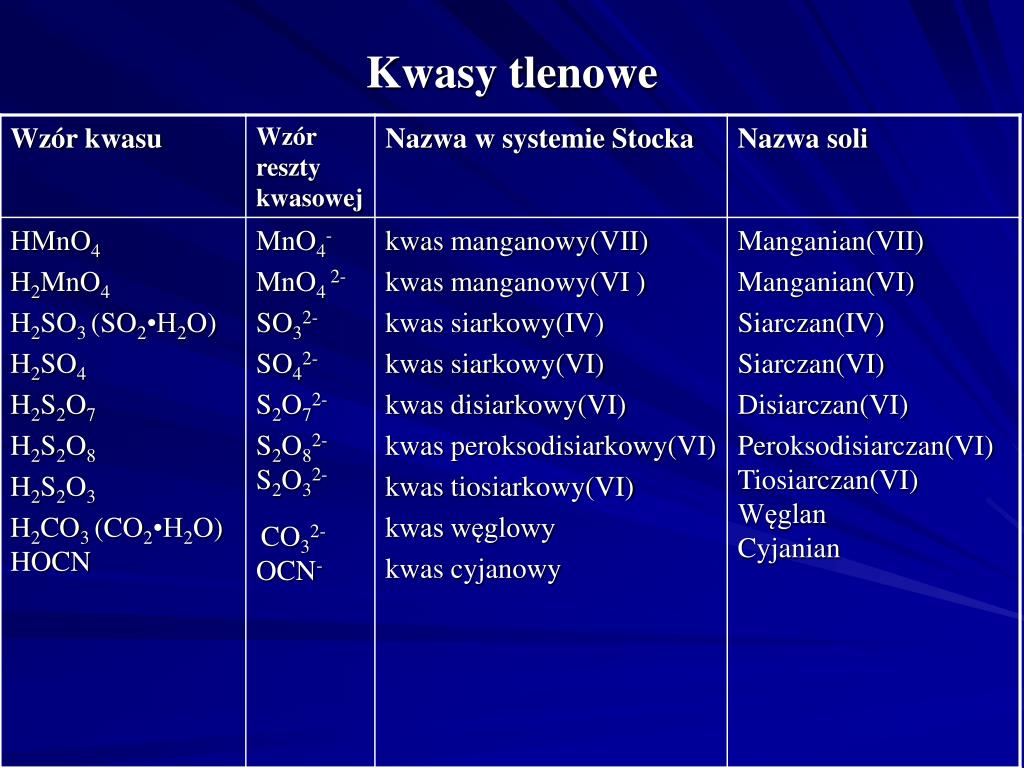
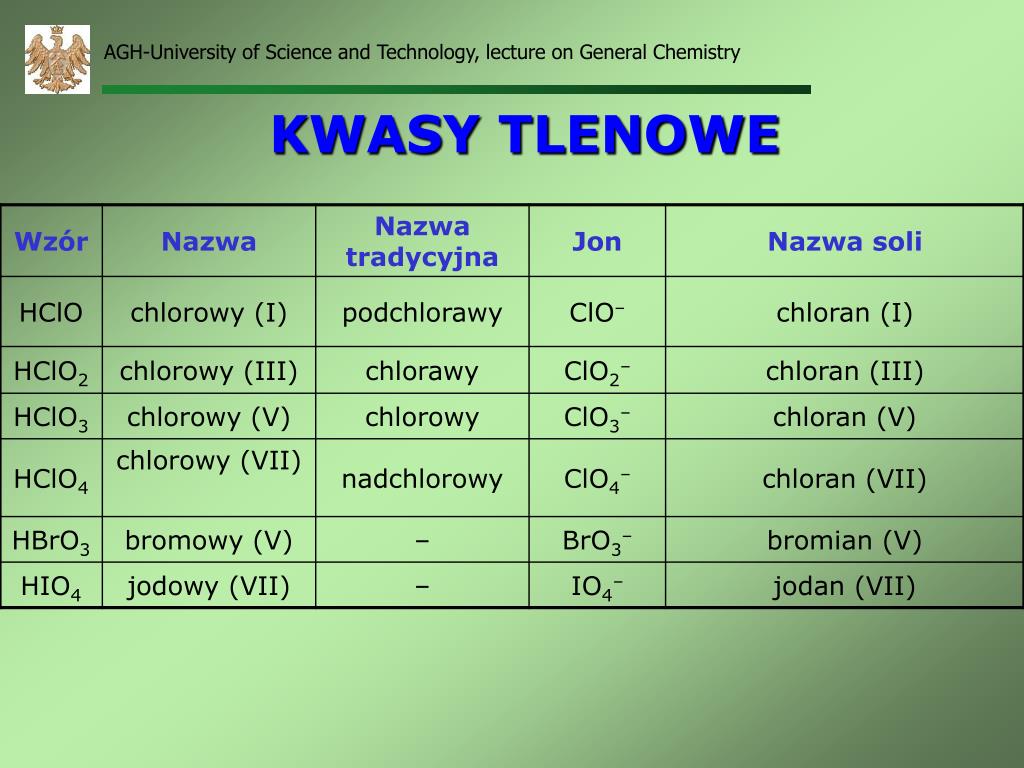
Kwasy tlenowe – z tlenem w składzie
Kwasy tlenowe, jak sama nazwa wskazuje, to kwasy, które w swojej budowie zawierają atom tlenu, oprócz atomów wodoru i niemetalu. Są to zazwyczaj kwasy mocniejsze i bardziej złożone niż kwasy beztlenowe.
Przykłady popularnych kwasów tlenowych to kwas siarkowy (VI) (H2SO4), kwas azotowy (V) (HNO3), kwas fosforowy (V) (H3PO4) i kwas węglowy (H2CO3). W nazwie kwasu tlenowego, liczba rzymska w nawiasie określa stopień utlenienia atomu centralnego (niemetalu).
Kwasy tlenowe powstają najczęściej w wyniku reakcji tlenków niemetali z wodą. Na przykład, tlenek siarki (VI) (SO3) reagując z wodą, tworzy kwas siarkowy (VI) (H2SO4). Ta reakcja jest bardzo istotna w procesie powstawania kwaśnych deszczy.
Przykłady kwasów tlenowych i ich zastosowania:
- Kwas siarkowy (VI) (H2SO4): Jeden z najważniejszych kwasów w przemyśle. Używany do produkcji nawozów, detergentów, tworzyw sztucznych i wielu innych produktów. Jest również elektrolitem w akumulatorach samochodowych.
- Kwas azotowy (V) (HNO3): Stosowany do produkcji nawozów sztucznych, materiałów wybuchowych i barwników. Jest również silnym utleniaczem.
- Kwas fosforowy (V) (H3PO4): Używany do produkcji nawozów fosforowych, detergentów i dodatków do żywności. Jest składnikiem napojów typu cola.
- Kwas węglowy (H2CO3): Powstaje w wyniku rozpuszczenia dwutlenku węgla (CO2) w wodzie. Jest słabym kwasem, obecnym w napojach gazowanych i odgrywa ważną rolę w regulacji pH krwi.
Jak odróżnić kwasy tlenowe od beztlenowych?
Najprostszym sposobem na odróżnienie kwasu tlenowego od beztlenowego jest sprawdzenie jego wzoru chemicznego. Jeśli wzór zawiera atom tlenu, to mamy do czynienia z kwasem tlenowym. Jeśli wzór nie zawiera atomu tlenu, to jest to kwas beztlenowy.
Oto kilka przykładów:
- HCl (kwas chlorowodorowy) – beztlenowy (brak tlenu)
- H2S (kwas siarkowodorowy) – beztlenowy (brak tlenu)
- H2SO4 (kwas siarkowy (VI)) – tlenowy (zawiera tlen)
- HNO3 (kwas azotowy (V)) – tlenowy (zawiera tlen)
Właściwości kwasów - co warto zapamiętać?
Wszystkie kwasy, niezależnie od tego, czy są tlenowe, czy beztlenowe, mają pewne wspólne właściwości:
- Kwaśny smak (pamiętaj! Nie wolno próbować kwasów!)
- Reagują z metalami, tworząc sole i wodór.
- Reagują z zasadami (reakcja neutralizacji), tworząc sole i wodę.
- Zmieniają barwę wskaźników (np. lakmusu na czerwono).
- Przewodzą prąd elektryczny (jako roztwory wodne).
Stopień dysocjacji, czyli rozpadu kwasu na jony w roztworze, determinuje jego moc. Mocne kwasy, takie jak kwas chlorowodorowy (HCl) i kwas siarkowy (VI) (H2SO4), dysocjują całkowicie, podczas gdy słabe kwasy, takie jak kwas węglowy (H2CO3), dysocjują tylko częściowo.
Bezpieczeństwo przede wszystkim!
Praca z kwasami wymaga zachowania szczególnej ostrożności. Kwasy są substancjami żrącymi, które mogą powodować poważne oparzenia skóry i uszkodzenia oczu. Podczas eksperymentów laboratoryjnych należy zawsze nosić okulary ochronne i rękawice. W przypadku kontaktu kwasu ze skórą, należy natychmiast przemyć skażone miejsce dużą ilością wody. Nigdy nie należy dodawać wody do stężonego kwasu! Zawsze dodajemy kwas do wody! Powolne dodawanie kwasu do wody i mieszanie zapobiega gwałtownemu wrzeniu i rozpryskiwaniu.
Podsumowanie – kwasy w pigułce
Zrozumienie różnicy między kwasami tlenowymi i beztlenowymi to kluczowy element wiedzy chemicznej. Pamiętaj:
- Kwasy beztlenowe nie zawierają atomów tlenu.
- Kwasy tlenowe zawierają atom tlenu.
- Wszystkie kwasy mają kwaśny smak, reagują z metalami i zasadami, zmieniają barwę wskaźników i przewodzą prąd elektryczny.
- Praca z kwasami wymaga zachowania szczególnej ostrożności.
Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć świat kwasów tlenowych i beztlenowych. Chemia może być fascynująca, jeśli podejdziemy do niej z ciekawością i otwartym umysłem! Powodzenia w nauce!
Zapamiętaj! Wiedza z chemii jest przydatna nie tylko w szkole, ale i w życiu codziennym. Pozwala nam lepiej zrozumieć świat wokół nas i podejmować świadome decyzje.
.jpg)