Kwasy I Wodorotlenki Sprawdzian Odpowiedzi

Sprawdzian z kwasów i wodorotlenków to częsta forma weryfikacji wiedzy z chemii na różnych etapach edukacji. Ugruntowane zrozumienie tych związków jest kluczowe, ponieważ odgrywają one zasadniczą rolę w wielu procesach chemicznych i biologicznych. Ten artykuł ma na celu usystematyzowanie wiedzy potrzebnej do efektywnego przygotowania się do takiego sprawdzianu, z uwzględnieniem typowych pytań i sposobów udzielania na nie odpowiedzi.
Podstawowe definicje i charakterystyka
Kwasy
Kwasy to związki chemiczne, które w roztworach wodnych dysocjują na jony wodorowe (H+) i aniony. Charakteryzują się kwaśnym smakiem (choć nigdy nie należy ich próbować w laboratorium!), zdolnością do reagowania z metalami (wypierając wodór) i neutralizacji zasad. Ich pH jest mniejsze niż 7. Ważne jest rozróżnienie między mocnymi i słabymi kwasami.
Mocne kwasy, takie jak kwas solny (HCl), kwas siarkowy (H2SO4) i kwas azotowy (HNO3), dysocjują w roztworach wodnych praktycznie całkowicie. Słabe kwasy, np. kwas octowy (CH3COOH) czy kwas węglowy (H2CO3), dysocjują w niewielkim stopniu, tworząc w roztworze mieszaninę jonów i niezdysocjowanych cząsteczek.
Przykładowe reakcje kwasów:
- Reakcja z metalem: Zn + 2HCl → ZnCl2 + H2
- Reakcja z zasadą (neutralizacja): HCl + NaOH → NaCl + H2O
Wodorotlenki
Wodorotlenki to związki chemiczne zawierające grupę hydroksylową (OH-) związaną z metalem. W roztworach wodnych dysocjują na jony metalu i jony hydroksylowe (OH-). Charakteryzują się mydlanym dotykiem (ostrożnie!), zdolnością do neutralizacji kwasów i pH większym niż 7. Podobnie jak kwasy, dzielimy je na mocne (zasady) i słabe.
Mocne wodorotlenki, zwane zasadami, to wodorotlenki metali grupy 1 i 2 układu okresowego (np. wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH), wodorotlenek wapnia (Ca(OH)2)). Dysocjują w roztworach wodnych praktycznie całkowicie. Słabe wodorotlenki, np. wodorotlenek amonu (NH4OH), dysocjują w niewielkim stopniu.
Przykładowe reakcje wodorotlenków:
- Reakcja z kwasem (neutralizacja): NaOH + HCl → NaCl + H2O
- Reakcja z solami metali ciężkich: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Nazewnictwo i wzory chemiczne
Poprawne nazywanie kwasów i wodorotlenków jest kluczowe. Nazwy kwasów zależą od reszty kwasowej. Na przykład, kwas chlorowodorowy (HCl) zawiera resztę chlorkową (Cl-), kwas siarkowy (H2SO4) zawiera resztę siarczanową (SO42-), a kwas azotowy (HNO3) resztę azotanową (NO3-).
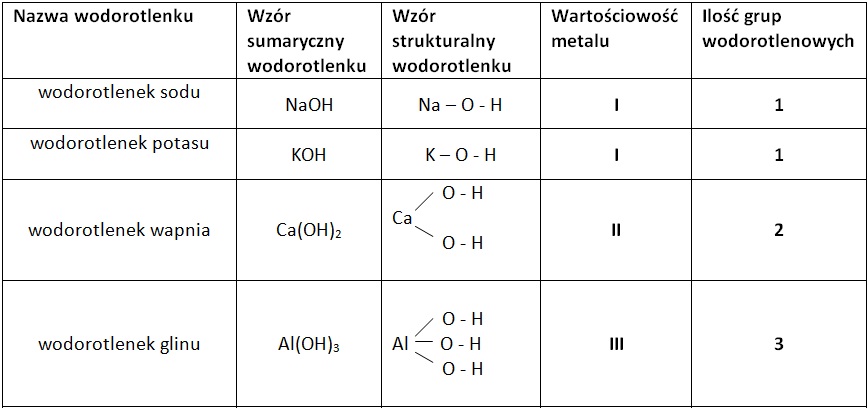
Nazwy wodorotlenków tworzy się, dodając słowo "wodorotlenek" do nazwy metalu, np. wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH). Jeśli metal występuje na różnych stopniach utlenienia, należy podać ten stopień w nawiasie, np. wodorotlenek żelaza(II) (Fe(OH)2), wodorotlenek żelaza(III) (Fe(OH)3).
Przykłady:
- HBr - kwas bromowodorowy
- H3PO4 - kwas fosforowy(V)
- Ca(OH)2 - wodorotlenek wapnia
- Al(OH)3 - wodorotlenek glinu
Wskaźniki pH
Wskaźniki pH to substancje, które zmieniają barwę w zależności od pH roztworu. Są one używane do szacunkowego określania odczynu roztworów. Do popularnych wskaźników należą:
- Lakmus: czerwony w roztworach kwaśnych, niebieski w roztworach zasadowych, fioletowy w roztworach obojętnych.
- Fenoloftaleina: bezbarwna w roztworach kwaśnych i obojętnych, malinowa w roztworach zasadowych.
- Oranż metylowy: czerwony w roztworach kwaśnych, żółty w roztworach zasadowych, pomarańczowy w roztworach obojętnych.
Uniwersalny papierek wskaźnikowy to mieszanina różnych wskaźników, która pozwala na bardziej precyzyjne określenie pH (w zakresie od 1 do 14) poprzez porównanie barwy papierka z dołączoną skalą barw.
Reakcje neutralizacji
Reakcja neutralizacji to reakcja kwasu z zasadą, w wyniku której powstaje sól i woda. Ogólny zapis reakcji to:
Kwas + Zasada → Sól + Woda
Na przykład:
HCl + NaOH → NaCl + H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
Reakcje neutralizacji są egzotermiczne, czyli wydzielają ciepło.
Przykłady zastosowań kwasów i wodorotlenków w życiu codziennym i przemyśle
Kwasy i wodorotlenki mają szerokie zastosowanie w różnych dziedzinach. Przykładowo:
- Kwas solny (HCl): stosowany w przemyśle chemicznym (do produkcji tworzyw sztucznych, barwników), w garbarstwie, do czyszczenia metali, a także w żołądku do trawienia pokarmu.
- Kwas siarkowy (H2SO4): stosowany w produkcji nawozów, detergentów, włókien syntetycznych, akumulatorów ołowiowych.
- Kwas octowy (CH3COOH): stosowany jako ocet spożywczy, konserwant, rozpuszczalnik.
- Wodorotlenek sodu (NaOH): stosowany w produkcji mydła, papieru, detergentów, do udrażniania rur.
- Wodorotlenek wapnia (Ca(OH)2): stosowany w budownictwie (jako składnik zaprawy murarskiej), w rolnictwie (do wapnowania gleby), w przemyśle spożywczym (do produkcji cukru).
Typowe pytania sprawdzianowe i strategie odpowiedzi
Identyfikacja kwasów i wodorotlenków
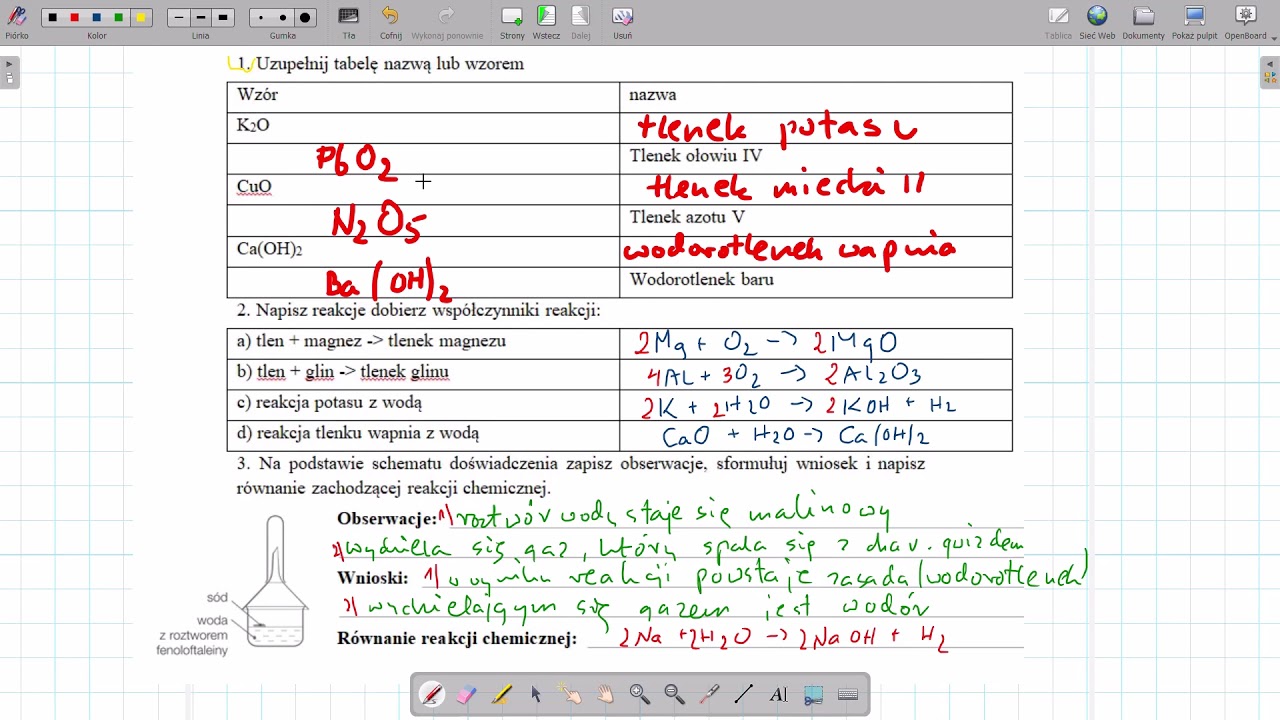
Pytanie: Podaj wzory sumaryczne i nazwy pięciu różnych kwasów i pięciu różnych wodorotlenków.
Odpowiedź: Należy podać prawidłowe wzory i nazwy. Upewnij się, że znasz nazewnictwo kwasów beztlenowych i tlenowych. Zwróć uwagę na prawidłowe wartościowość pierwiastków przy tworzeniu wzorów.
Właściwości i reakcje
Pytanie: Opisz właściwości kwasów i wodorotlenków. Podaj przykłady reakcji neutralizacji.
Odpowiedź: Należy opisać charakterystyczne cechy kwasów i wodorotlenków (smak, dotyk, wpływ na wskaźniki, reakcje z metalami, tlenkami metali, kwasami i zasadami). W przypadku reakcji neutralizacji, podaj zbilansowane równania reakcji.
Wskaźniki pH
Pytanie: Jak zmienia się barwa lakmusu, fenoloftaleiny i oranżu metylowego w roztworach kwasowych i zasadowych?
Odpowiedź: Należy znać zmiany barw poszczególnych wskaźników w zależności od pH roztworu. Pamiętaj, że lakmus barwi się na czerwono w kwasach i na niebiesko w zasadach, a fenoloftaleina jest bezbarwna w kwasach i malinowa w zasadach.
Obliczanie pH
Pytanie: Oblicz pH roztworu HCl o stężeniu 0,01 mol/dm3.
Odpowiedź: (Zaawansowane) Ponieważ HCl jest mocnym kwasem, całkowicie dysocjuje w wodzie. Dlatego stężenie jonów H+ jest równe stężeniu HCl, czyli [H+] = 0,01 mol/dm3. pH obliczamy ze wzoru: pH = -log[H+] = -log(0,01) = 2.
Dodatkowe wskazówki
- Zapamiętaj kluczowe definicje: zrozumienie definicji kwasów, wodorotlenków, pH i wskaźników to podstawa.
- Ćwicz nazewnictwo: poprawne nazywanie związków to klucz do sukcesu.
- Rozwiązuj zadania: praktyczne ćwiczenia pomagają utrwalić wiedzę.
- Korzystaj z pomocy: w razie wątpliwości pytaj nauczyciela lub kolegów.
Przygotowanie do sprawdzianu z kwasów i wodorotlenków wymaga systematycznej pracy i powtórzenia materiału. Zrozumienie podstawowych definicji, właściwości i reakcji tych związków chemicznych pozwoli Ci na bezproblemowe rozwiązanie zadań i uzyskanie wysokiego wyniku.