Kwas Octowy Jest Zaliczany Do Kwasów Karboksylowych Ponieważ
Kwas octowy, powszechnie znany jako składnik octu spożywczego, odgrywa kluczową rolę w wielu procesach chemicznych i biologicznych. Jego obecność jest nieodzowna w kuchni, przemyśle, a nawet w organizmach żywych. Jednak, aby w pełni zrozumieć jego właściwości i zachowanie, konieczne jest zrozumienie jego klasyfikacji w chemii organicznej, a konkretnie przynależności do kwasów karboksylowych. Zastanówmy się zatem, dlaczego kwas octowy jest zaliczany do tej właśnie grupy związków.
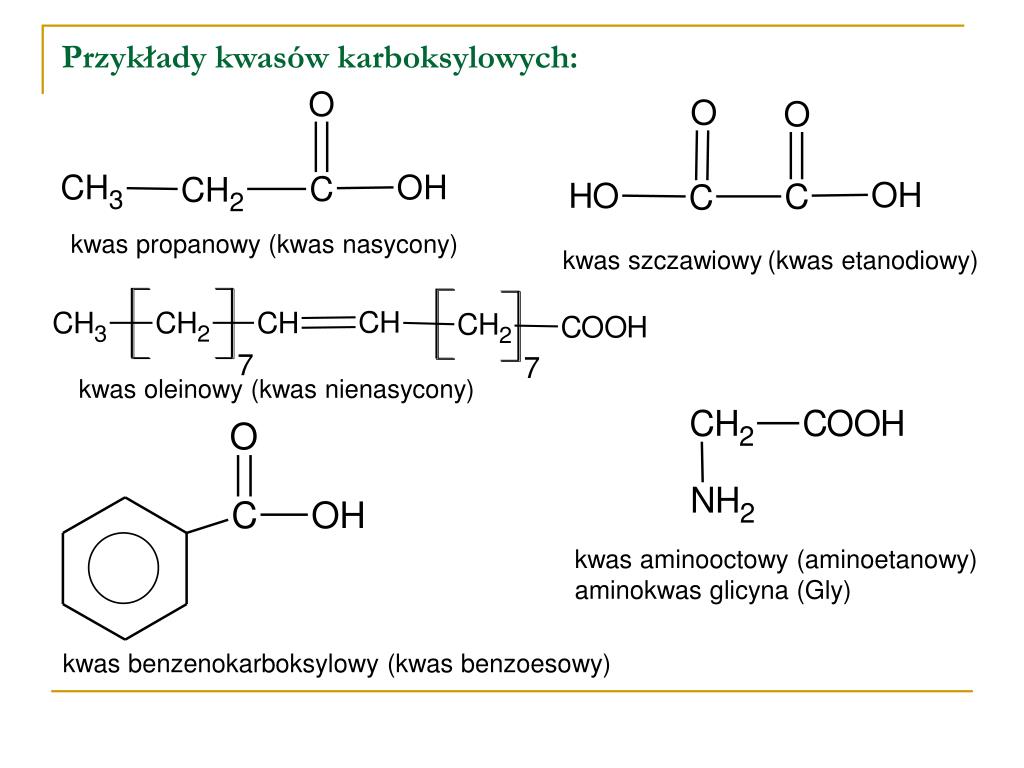
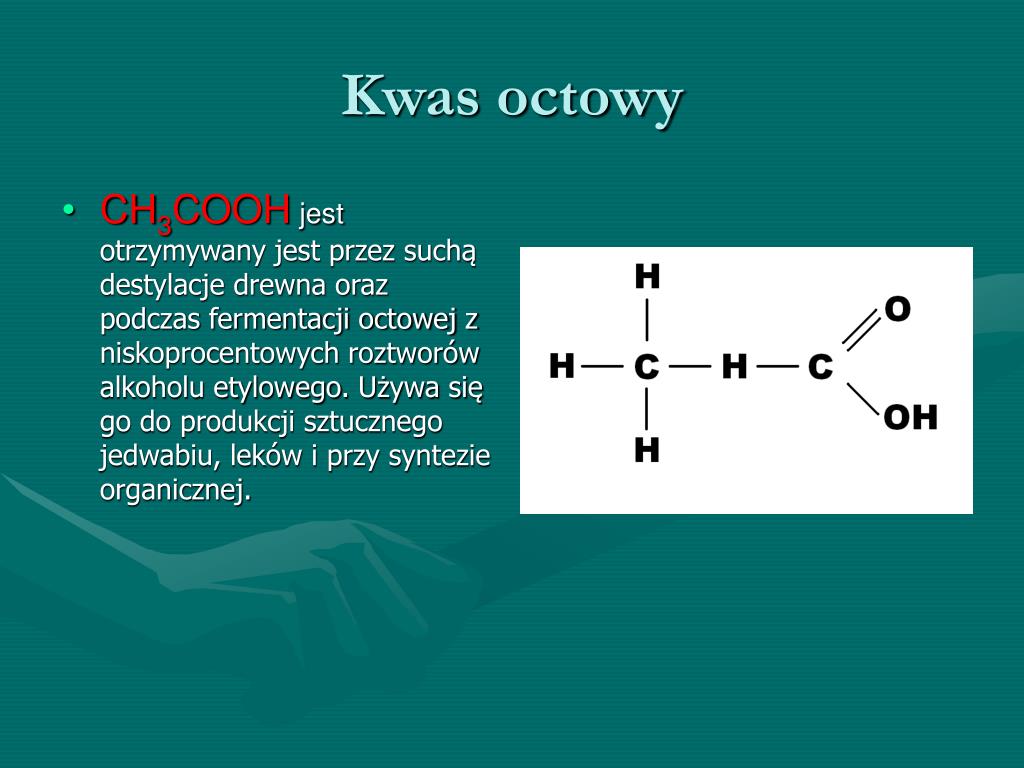
Kwas octowy, o wzorze sumarycznym CH3COOH, charakteryzuje się obecnością specyficznej grupy funkcyjnej, kluczowej dla jego przynależności do kwasów karboksylowych. Ta grupa funkcyjna to grupa karboksylowa, -COOH. To właśnie jej obecność decyduje o kwasowym charakterze związku organicznego i szeregu unikalnych właściwościach, które kwas octowy wykazuje.
Grupa karboksylowa składa się z dwóch elementów: grupy karbonylowej (C=O) oraz grupy hydroksylowej (-OH), przyłączonych do tego samego atomu węgla. To unikalne połączenie wpływa na polarność i reaktywność całej grupy, a co za tym idzie, całego związku. Atom węgla w grupie karboksylowej jest związany podwójnym wiązaniem z atomem tlenu (tworzącym grupę karbonylową) i pojedynczym wiązaniem z atomem tlenu grupy hydroksylowej. Dodatkowo, atom węgla jest związany z resztą cząsteczki, w przypadku kwasu octowego jest to grupa metylowa (CH3-).
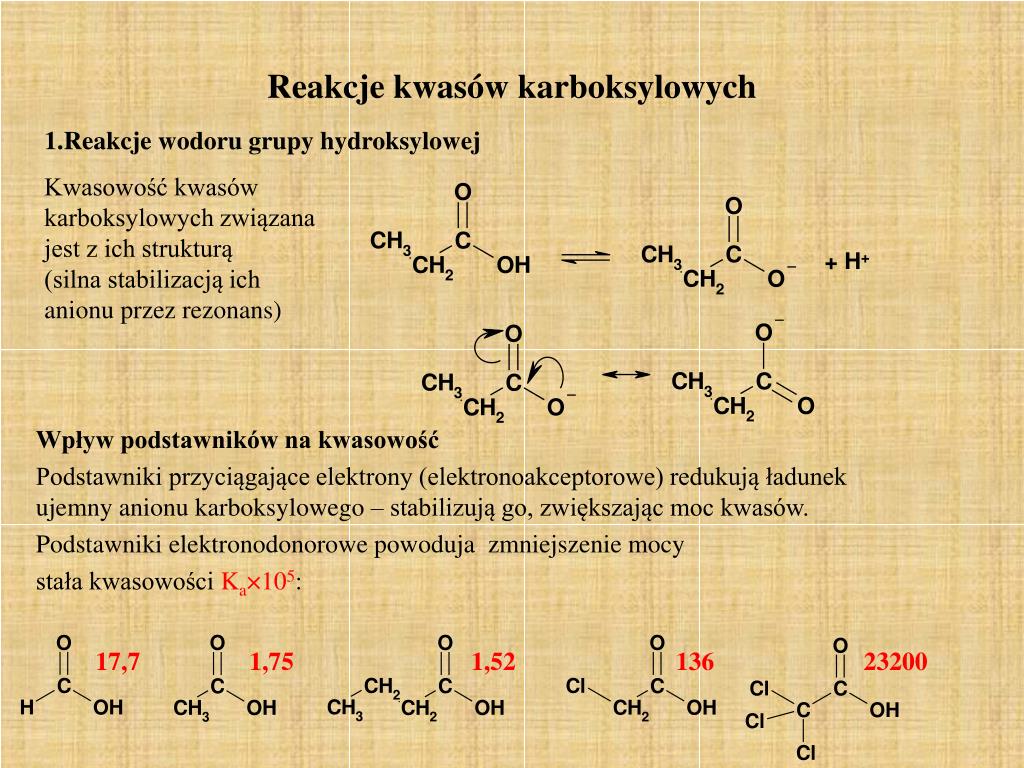
Polarność grupy karboksylowej wynika z różnicy elektroujemności atomów tlenu, węgla i wodoru. Atomy tlenu są bardziej elektroujemne niż atom węgla i wodoru, co powoduje przesunięcie gęstości elektronowej w ich kierunku. To z kolei prowadzi do powstania cząstkowego ładunku ujemnego na atomach tlenu i cząstkowego ładunku dodatniego na atomie węgla i wodorze. Szczególnie istotny jest atom wodoru w grupie hydroksylowej. Jest on związany z bardzo elektroujemnym atomem tlenu, co osłabia wiązanie O-H. W efekcie, atom wodoru może łatwo odszczepiać się w postaci jonu wodorowego (H+), co jest kluczowe dla kwasowych właściwości kwasu octowego.
To właśnie zdolność do oddawania protonu (jonu wodorowego) definiuje kwasowość związku. W roztworze wodnym kwas octowy dysocjuje, czyli rozpada się na jon octanowy (CH3COO-) i jon wodorowy (H+). Proces ten jest równowagowy, co oznacza, że nie wszystkie cząsteczki kwasu octowego ulegają dysocjacji. Siła kwasu zależy od stopnia dysocjacji; im więcej jonów wodorowych powstaje w roztworze, tym silniejszy jest kwas. Kwas octowy jest kwasem słabym, co oznacza, że dysocjuje w niewielkim stopniu. Mimo to, jego zdolność do oddawania protonu jest wystarczająca, aby wykazywał charakterystyczne właściwości kwasowe.
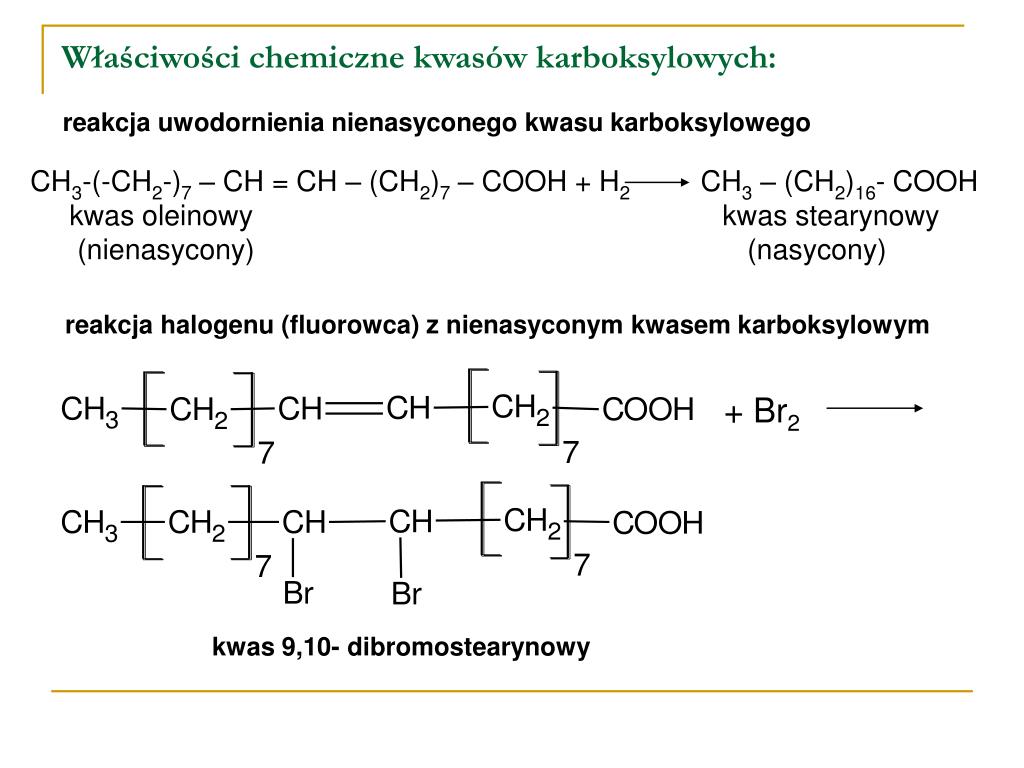
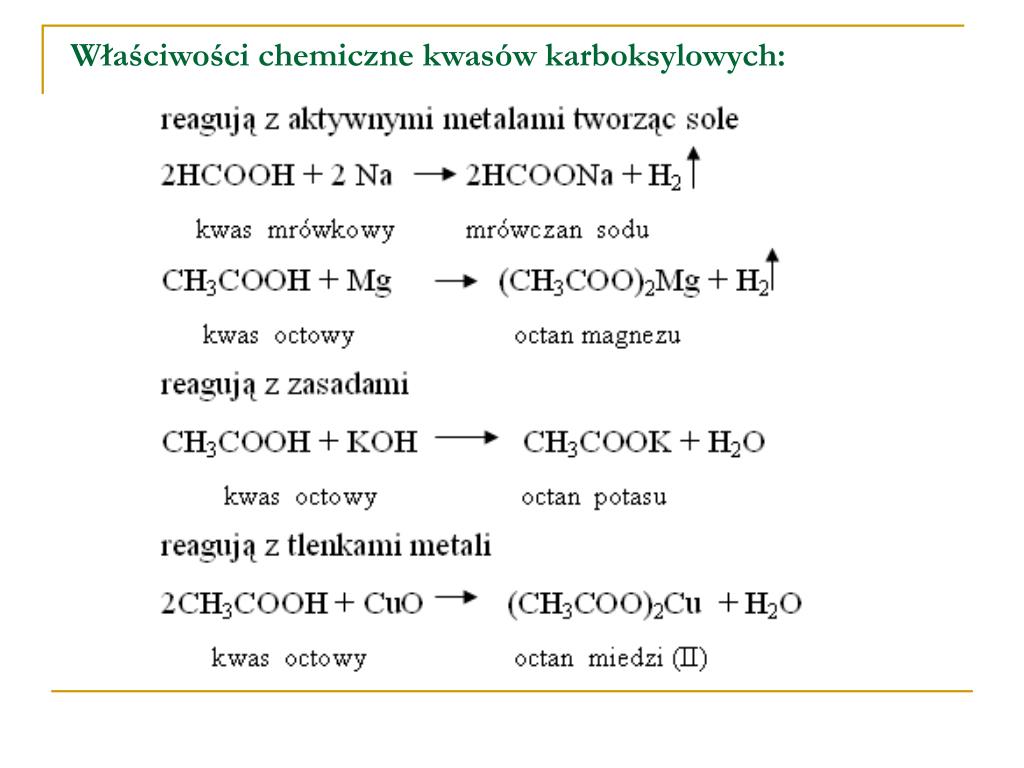
Jedną z najważniejszych właściwości kwasów karboksylowych, w tym kwasu octowego, jest ich zdolność do reagowania z zasadami. Reakcja ta, zwana reakcją zobojętniania, polega na łączeniu się jonu wodorowego (H+) z jonem hydroksylowym (OH-) pochodzącym z zasady, tworząc wodę (H2O). W wyniku reakcji zobojętniania kwasu octowego z zasadą powstaje sól i woda. Na przykład, reakcja kwasu octowego z wodorotlenkiem sodu (NaOH) prowadzi do powstania octanu sodu (CH3COONa) i wody.
Kwas octowy reaguje również z metalami aktywnymi, takimi jak sód czy potas. W wyniku tej reakcji powstaje sól kwasu octowego i wodór. Reakcja ta jest bardziej gwałtowna niż reakcja z zasadami, ponieważ metale aktywne łatwo oddają elektrony, co przyspiesza proces tworzenia jonów.
Ponadto, kwas octowy może ulegać reakcji estryfikacji. Jest to reakcja z alkoholem, w wyniku której powstaje ester i woda. Reakcja ta wymaga obecności katalizatora kwasowego, takiego jak kwas siarkowy. Estry charakteryzują się często przyjemnym zapachem i znajdują zastosowanie w przemyśle spożywczym i perfumeryjnym.
Znaczenie grupy karboksylowej w chemii organicznej
Obecność grupy karboksylowej nie tylko definiuje kwasowość związku, ale także wpływa na jego inne właściwości fizyczne i chemiczne. Grupa karboksylowa jest polarna, co wpływa na rozpuszczalność kwasu octowego w wodzie. Dzięki polarności, kwas octowy może tworzyć wiązania wodorowe z cząsteczkami wody, co zwiększa jego rozpuszczalność. Krótkie kwasy karboksylowe, takie jak kwas octowy, są dobrze rozpuszczalne w wodzie, natomiast rozpuszczalność długołańcuchowych kwasów karboksylowych jest mniejsza, ze względu na hydrofobowy charakter długiego łańcucha węglowodorowego.
Temperatura wrzenia kwasu octowego jest wyższa niż temperatura wrzenia alkoholu o podobnej masie cząsteczkowej. Wynika to z faktu, że kwas octowy tworzy silniejsze wiązania wodorowe między cząsteczkami niż alkohol. Dwie cząsteczki kwasu octowego mogą tworzyć dimer, w którym dwie grupy karboksylowe łączą się poprzez dwa wiązania wodorowe. Dimeryzacja zwiększa masę cząsteczkową efektywną, co podnosi temperaturę wrzenia.
Obecność grupy karboksylowej wpływa również na reaktywność kwasu octowego. Grupa karboksylowa może ulegać różnym przemianom chemicznym, co czyni kwas octowy cennym substratem w syntezie organicznej. Może być przekształcana w inne grupy funkcyjne, takie jak estry, amidy, chlorki kwasowe i aldehydy.
Podsumowując, kwas octowy jest zaliczany do kwasów karboksylowych ze względu na obecność grupy karboksylowej (-COOH) w swojej strukturze. Ta grupa funkcyjna odpowiada za jego kwasowe właściwości, zdolność do reagowania z zasadami, metalami i alkoholami, a także wpływa na jego właściwości fizyczne, takie jak rozpuszczalność i temperatura wrzenia. Zrozumienie roli grupy karboksylowej jest kluczowe dla zrozumienia chemii organicznej i właściwości związków zawierających tę grupę funkcyjną. Bez grupy karboksylowej, kwas octowy nie wykazywałby swoich charakterystycznych właściwości i nie byłby tak szeroko wykorzystywany w różnych dziedzinach nauki i przemysłu. Jego przynależność do kwasów karboksylowych determinuje jego zachowanie i zastosowania, co czyni go ważnym przykładem związku organicznego. Wiedza na temat budowy i właściwości kwasu octowego pozwala na lepsze zrozumienie procesów chemicznych, w których bierze udział, a także na przewidywanie jego zachowania w różnych warunkach.